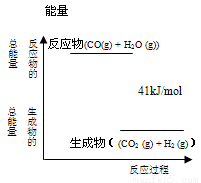
摘要: CO(g)+H2O(g)= CO2(g)+H2(g)反应过程的能量变化如图所示.有关两者反应的说法正确的是 A.该反应为吸热反应 B.CO(g)与H2O(g)所具有的总能量大于CO2(g)与H2(g)所具有的总能量 C.反应的热化学方程式是:CO(g) + H2O (g) = CO2(g) + H2(g),△H=+41kJ/mol D. 1mol CO2(g)和1mol H21mol和H2O(g)要放出41kJ热量 高☆考♂资♀源?网
网址:http://m.1010jiajiao.com/timu3_id_216436[举报]
已知:①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1="-41.2" kJ/mol
CO2(g)+H2(g) ΔH1="-41.2" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g) ΔH3
CO(g)+3H2(g) ΔH3
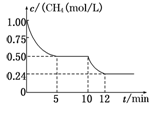
若反应③在一体积恒定为1 L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是
 CO2(g)+H2(g) ΔH1="-41.2" kJ/mol
CO2(g)+H2(g) ΔH1="-41.2" kJ/mol②CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol③CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH3
CO(g)+3H2(g) ΔH3若反应③在一体积恒定为1 L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是

| A.ΔH3=+206.1 kJ/mol |
| B.反应③进行到10 min时,改变的外界条件可能是升高温度 |
| C.反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ |
| D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
已知:①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1="-41.2" kJ/mol
CO2(g)+H2(g) ΔH1="-41.2" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g) ΔH3
CO(g)+3H2(g) ΔH3
若反应③在一体积恒定为1 L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是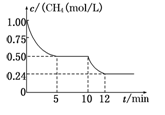
| A.ΔH3=+206.1 kJ/mol |
| B.反应③进行到10 min时,改变的外界条件可能是升高温度 |
| C.反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ |
| D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
(4分)已知一定条件下,CO(g) + H2O (g) CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。
查看习题详情和答案>>
 CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。
CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。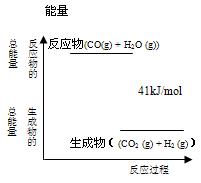
 CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为:
。
CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为:
。