网址:http://m.1010jiajiao.com/timu3_id_215573[举报]
下列说法正确的是( )
A.如图可表示水分解过程中的能量变化
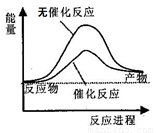
B.若2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H=- a kJ/mol,
Ⅱ: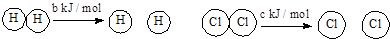
且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c
查看习题详情和答案>>
下列说法正确的是
A.右图可表示水分解过程中的能量变化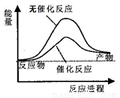
B.若2C(s)+O2(g)=2CO(g) △H= -221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H= - a kJ/mol,
Ⅱ: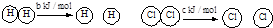
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ
查看习题详情和答案>>
下列说法正确的是
A.右图可表示水分解过程中的能量变化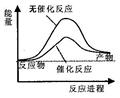 |
| B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol, |

且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ 查看习题详情和答案>>
(18分)应用化学反应需要研究化学反应的条件、限度和速率。
![]() (1)已知反应:Br2+2Fe2+=2Br-+2Fe3+,向10 mL 0.1 mol?L-1的FeBr2溶液中通入0.001mol Cl2,反应后,溶液中除含有Cl-外,还一定 (填序号)。
(1)已知反应:Br2+2Fe2+=2Br-+2Fe3+,向10 mL 0.1 mol?L-1的FeBr2溶液中通入0.001mol Cl2,反应后,溶液中除含有Cl-外,还一定 (填序号)。
![]() ① 含Fe2+,不含Fe3+ ② 含Fe3+,不含Br- ③ 含Fe3+,含有Br-
① 含Fe2+,不含Fe3+ ② 含Fe3+,不含Br- ③ 含Fe3+,含有Br-
![]() (2)773 K,固定体积的容器中,反应CO(g)+2H2(g)
(2)773 K,固定体积的容器中,反应CO(g)+2H2(g) ![]() CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率为 ;
② 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ 下列与催化剂有关的说法中,正确的是 (填字母序号)。
a.使用催化剂,使反应CO(g)+2H2(g) ![]() CH3OH(g) ΔH>-91 kJ?mol-1
CH3OH(g) ΔH>-91 kJ?mol-1
b.使用催化剂,不能改变反应的平衡常数K
c.使用催化剂,能够提高反应物转化率
![]() (3)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
(3)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Fe电极作 极(填“阴”或“阳”);
② Ni电极的电极反应式为: 。
(4)氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:
NO3-+4H++3e-= NO+2H2O
①KMnO4、Na2CO3、CuO、KI四种物质中的 (填化学式)能使上述还原过程发生。
②欲用下图装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定 推(计)算反应速率。
查看习题详情和答案>>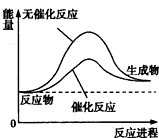 下列说法正确的是( )
下列说法正确的是( )