摘要: 在反应:3NO2+H2O=2HNO3+NO中.NO2的作用是 A.只作氧化剂 B.既是氧化剂又是还原剂 C.只作还原剂 D.既不是氧化剂也不是还原剂
网址:http://m.1010jiajiao.com/timu3_id_215229[举报]
 (2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.(1)用化学方程式表示NO形成硝酸型酸雨的反应
2NO+O2═2NO2、3NO2+H2O═2HNO3+NO
2NO+O2═2NO2、3NO2+H2O═2HNO3+NO
(2)能作脱除剂的物质很多,下列说法正确的是
ab
ab
a.用 H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用 Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2.
Ⅰ.已知可通过下列方法合成尿素:
2NH3(g)+CO2(g)?H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)?CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是
CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol
CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol
②写出有利于尿素释放NH3的条件并说明理由
升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行
升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行
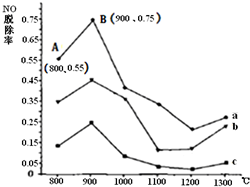
Ⅱ.CO(NH2)2与某种烟气(主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a 对应CO(NH2)2 与NO的物质的量比值是
3:1
3:1
.②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是
4NH3+6NO═5N2+6H2O或2CO(NH2)2+6NO═2CO2+4H2O+5N2
4NH3+6NO═5N2+6H2O或2CO(NH2)2+6NO═2CO2+4H2O+5N2
.③900℃~1200℃区间内脱除率下降,NO浓度上升.发生的主要反应是
4NH3+5O2═4NO+6H2O
4NH3+5O2═4NO+6H2O
.④曲线a中,NO的起始浓度为6×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
1.5×10-4
1.5×10-4
mg/(m3?s).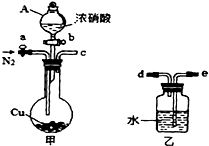 (2012?宁德模拟)某化学课外小组利用如图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成.
(2012?宁德模拟)某化学课外小组利用如图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成.请回答下列问题:
(1)仪器A的名称是
分液漏斗
分液漏斗
.(2)甲装置的c应该与乙装置的
e
e
连接(填“d”或“e”).(3)乙装置中反应的化学方程式是
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(4)实验步骤如下:
i仪器组装完毕,检查装置的气密性,加入试剂.打开旋塞a,通入N2一段时间后,关闭旋塞a.
ii打开旋塞b,滴加入xmol?L-1浓硝酸V mL,充分反应后冷却,固体仍有剩余.
iii用NaOH溶液滴定乙装置中溶液,得溶质的物质的量为n mol.
①步骤i通入N2的目的是
赶尽装置中的空气
赶尽装置中的空气
②为了准确测定甲装置中产生NO2的量,在步骤ii和iii之间应补充的操作是:
打开a,关闭b,通入N2一段时间
打开a,关闭b,通入N2一段时间
.③当xV×l0-3
>
>
3n(填“>”、“=”或“<”),则证明铜与浓硝酸反应时有NO生成.④该实验设计中存在一个明显的缺陷是
缺少尾气吸收装置
缺少尾气吸收装置
.硝酸大量用于制造无机肥料,如硝酸铵、硝酸钙、硝酸磷肥,还广泛用于其他工业生产.硝酸工业生产流程图如图所示:
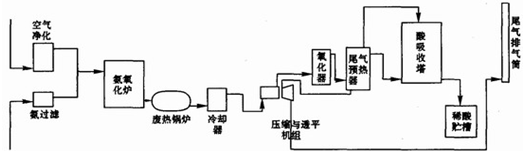
(1)第-步是氨的接触氧化,在一定温度下以铂铑网作为催化剂,写出该反应的化学方程式
(2)在吸收塔中用水循环吸收NO2得到硝酸,写出发生反应的化学方程式
(3)尾气中含有氮的氧化物,直接排放到空气中会危害环境,写出一项氮的氧化物可能引起的环境问题
查看习题详情和答案>>

(1)第-步是氨的接触氧化,在一定温度下以铂铑网作为催化剂,写出该反应的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)在吸收塔中用水循环吸收NO2得到硝酸,写出发生反应的化学方程式
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
,该过程是放热的,为了使吸收效果更好在吸收过程中需要控制在低温高压
低温高压
条件下.(3)尾气中含有氮的氧化物,直接排放到空气中会危害环境,写出一项氮的氧化物可能引起的环境问题
光化学烟雾、酸雨、破坏臭氧层等
光化学烟雾、酸雨、破坏臭氧层等
.工业上常用纯碱溶液吸收NO2,生成亚硝酸盐、硝酸盐和其他物质,写出该反应的化学方程式2NO2+Na2CO3=NaNO3+NaNO2+CO2
2NO2+Na2CO3=NaNO3+NaNO2+CO2
. 工业合成氨与制备硝酸一般可连续生产,流程如下:
工业合成氨与制备硝酸一般可连续生产,流程如下:
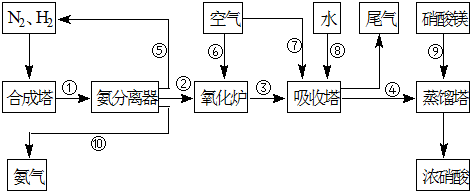
(1)合成塔中发生反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).下表为不同温度下该反应的平衡常数.
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
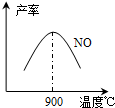
(2)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)+905kJ,不同温度下NO气体的产率如图所示.温度高于900℃时,NO气体产率下降的原因是______.
(3)吸收塔中反应为:3NO2+H2O?2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因是______.
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)+574kJ;
CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)+1160kJ.
则1mol甲烷直接将NO2还原为N2的热化学方程式为:______. 查看习题详情和答案>>