摘要:10.在密闭容器中进行反应:2A+3B2C.开始时C的浓度为1mol·L-1.5min后C的浓度变为2mol·L-1.A和B的物质的量浓度均变为原来的1/2.则下列说法中正确的是( ). A.反应开始时.c(B)=3mol·L-1 B.用B表示的反应速率是0.75mol/ C.反应5min后.c(A)=0.5mol·L-1 D.反应5min后.c(B)=2mol·L-1
网址:http://m.1010jiajiao.com/timu3_id_215123[举报]
在密闭容器中进行反应,A与B反应生成C,其反应速率分别用ν A、ν B、ν C(mol?L-1?s-1)表示,且ν A、ν B、ν C之间有如下所示的关系:νB=3ν A;3ν C=2ν B.则此反应可表示为( )
查看习题详情和答案>>
 (2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示:
(2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示:请回答:
(1 )反应①的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
(2)以D为燃气,E、G的混合气体为助燃气,熔融K2CO3为电解质的燃料电池中,负极的反应式为
CO+CO32--2e-=2CO2
CO+CO32--2e-=2CO2
(3)已知:D和W的燃烧热分别为-283.0kJ/mol,-285.8kJ/mol,1 mol A由液态变为气态时吸收热量44kJ,反应②的热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ/mol
.(4)将标准状况下4.48L G通入到100mL 3mol/L F溶液中,充分反应后,所得溶液中离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
(5)一定温度下,反应②的平衡常数为
| 9 |
| 4 |
| 物质 | A | D | G | W |
| 浓度/(mol?L-1) | 0.45 | 0.45 | 0.55 | 0.55 |
>
>
v逆(填“<“、“>”或“=”).②反应达到平衡时W的浓度c(W)=
0.6mol/L
0.6mol/L
.在密闭容器中进行反应:X2(g)+Y2(g)?2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol?L-1、0.3mol?L-1、0.2mol?L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.35mol?L-1 | B、Y2为0.45mol?L-1 | C、X2为0.2 mol?L-1 | D、Z为0.4mol?L-1 |
下列说法正确的是
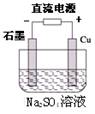
A.Cu(s)+2H2O(l)===2Cu(OH)2 (s)+H2(g),该反应可通过上图装置来实现
B.在体积可变的密闭容器中进行反应:CaCO3(s)  CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动
CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动
C.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH<0,由该反应可知物质能量关系一定符合:E [ZnSO4(aq)] < E [CuSO4(aq)]
D.在密闭容器中进行反应:HI(g)  1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量
1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量
查看习题详情和答案>>
下列说法正确的是
A.Cu(s)+2H2O(l)===2Cu(OH)2 (s)+H2(g),该反应可通过上图装置来实现
B.在体积可变的密闭容器中进行反应:CaCO3(s) CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动
C.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH<0,由该反应可知物质能量关系一定符合:E [ZnSO4(aq)]< E [CuSO4(aq)]
D.在密闭容器中进行反应:HI(g) 1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量
查看习题详情和答案>>