网址:http://m.1010jiajiao.com/timu3_id_214079[举报]
| 元素 | A | B | C | D | E | F | G |
| 性 质 结 构 信 息 |
制成的高压灯,发出的黄光透雾能力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达稳定结构. | 常温常压下是气体,元素的常见化合价为-1及多种正价. | +2价阳离子核外电子数与氖原子相同. | E和F是同主族元素,都有同素异形体.E的一种分子与F原子电子数目相同. | 常温下,其单质能与烧碱溶液反应放出气体,其氧化物能与强酸或强碱溶液反应. | |
(2)写出D离子的结构示意图


(3)写出C单质与水反应的化学方程式
(4)写出G与烧碱溶液反应的离子方程式
(5)写出F元素常见的两种同素异形体的名称
(6)对元素B的单质或化合物描述正确的是(填序号)
①B元素的最高正价为+6 ②常温常压下,其单质很难与其他物质反应
③单质分子中含有18个电子 ④其氢化物极易溶于水
(7)C、E和F 三种元素的氢化物中,沸点最高的氢化物的化学式是
(8)A和D 两元素金属性较强的是(填元素符号)
又已知:①G、E均能发生银镜反应;
②F与NaHCO3溶液反应能产生气体;
③C的水溶液被称为福尔马林。
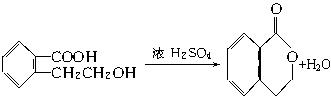
回答下列问题:
(1)F分子中含有的官能团的名称是:_______________________。
(2)由F转化成H的反应类型属于(选填序号)。
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(3)一个A的分子中应有____________个(选填2、3、4…等)氧原子,作出此判断的理由是:____________________________________________________________。
(4)由F生成H的化学方程式为______________________。
(5)H的同分异构体甚多。请写出符合下列条件的同分异构体的结构简式(任写三种):
①苯环上只有一个取代基;
②能够与NaOH溶液反应。
____________________________________。
查看习题详情和答案>>元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 33.35 | 164 |
(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。
查看习题详情和答案>>
元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 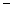 33.35 33.35 | 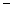 164 164 |
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。
 查看习题详情和答案>>
查看习题详情和答案>>
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表是元素周期表的一部分,根据周期表知识回答下列问题。
| | | | |||||||||||||||
| | | | | | | A | | | |||||||||
| | B | C | | | D | E | | ||||||||||
| | | | | | | | | | | | | | | | | | |
(2)比较这五种元素的原子半径从大到小 (填元素符号);
(3)上述五种元素的最高价氧化物对应水化物酸性最强的是 (填化学式);
(4)写出A和C形成的化合物与氢氧化钠溶液反应的离子方程式:
;
(5)用电子式表示B和E形成化合物的过程:
。 查看习题详情和答案>>