网址:http://m.1010jiajiao.com/timu3_id_214049[举报]
(11分)回答下列问题
(1)在2FeBr2+3Cl2=2FeCl3+2Br2的反应中,被氧化的元素是_____________
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2);浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2)。则Cl2、Fe3+、MnO4-氧化性由强到弱的顺序是____________________。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式____________________________________________。
(4)在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+2OH-=RO42-+2Cl-+H2O
由以上反应可知在上述过程中RO3n-被________________(填“氧化”或“还原”),RO3n-中元素R的化合价是______________。
(11分)回答下列问题
(1)在2FeBr2+3Cl2=2FeCl3+2Br2的反应中,被氧化的元素是_____________
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2);浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2)。则Cl2、Fe3+、MnO4-氧化性由强到弱的顺序是____________________。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式____________________________________________。
(4)在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+2OH-=RO42-+2Cl-+H2O
由以上反应可知在上述过程中RO3n-被________________(填“氧化”或“还原”),RO3n-中元素R的化合价是______________。
查看习题详情和答案>>
(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________.

(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的?H表示生成1 mol产物的数据).根据上图回答下列问题:

①P和Cl2反应生成PCl3的热化学方程式________;
②PCl5分解成PCl3和Cl2的热化学方程式是________;
(3)科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇(CH3OH)为燃料的燃料电池.已知:
CO(g)+1/2O2(g)=CO2(g); ΔH=-283.0 kJ·mol-1;
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1.
请回答下列问题:
液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为________
(4)已知稀溶液中,H2SO4与1 mol NaOH溶液恰好完全反应时,放出57.3 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式________.
(5)25℃、101 kPa条件下充分燃烧一定量的甲烷气体生成CO2气体和液态水,放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出甲烷燃烧的热化学方程式________.
(6)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
![]()
写出常温常压下氢气与氯气反应的热化学方程式________;
该反应中氢气与氯气的总能量________(填“大于”、“等于”、“小于”)氯化氢的总能量.
ⅠNO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”.请回答下列问题.
(1)NO的危害在于
A.破坏臭氧层 B.高温下能使一些金属氧化
C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子(NO2-)在酸性水溶液中反应的离子方程式:
(3)已知NH3和Cl2会发生氧化还原反应,生成N2和NH4Cl.现用如图1所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至三分之二处.
①写出实验室制取氨气的化学方程式
②试管内发生反应的化学方程式是
③试管中发生的反应表明氨气具有
a、氧化性 b、还原性 c、碱性 d、热不稳定性
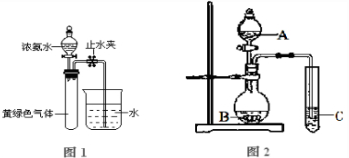
Ⅱ(1)将SO2通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,知其中含Cl:35.7%,Cu:64.3%,则SO2在上述反应中的作用是
a.漂白剂 b.氧化剂 c.还原剂
(2)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用H2O2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
(3)用上图2实验装置可以证明硫、碳、硅三种元素的非金属性强弱.则A、B、C所代表的物质的名称:A