摘要: 有下列5种物质:1Ar.2CO2.3KOH.4K2S.5Na2O2.微粒间只存在共价键的是 ,只存在离子键的是 ,既存在离子键.又存在极性共价键的是 ,既存在离子键.又存在非极性共价键的是 ,不存在化学键的是 .(用编号填空) 四.实验题(本大题只有1个小题.共4分)
网址:http://m.1010jiajiao.com/timu3_id_213559[举报]
有下列几种物质
A.石墨和金刚石 B.35Cl和37Cl C.CH3CH=CHCH3 和(CH3)2C=CH2 D.丁烷和新戊烷
E.
请把合适字母填入以下横线里:
(1)属于同素异形体的是
(3)属于同分异构体的是
(5)属于同种物质的是
查看习题详情和答案>>
A.石墨和金刚石 B.35Cl和37Cl C.CH3CH=CHCH3 和(CH3)2C=CH2 D.丁烷和新戊烷
E.

请把合适字母填入以下横线里:
(1)属于同素异形体的是
A
A
; (2)属于同位素的是B
B
;(3)属于同分异构体的是
C
C
; (4)属于同系物的是D
D
;(5)属于同种物质的是
E
E
.有下列10种物质:①苯酚,②乙酸,③牛油,④丙氨酸,⑤乙酸乙酯,⑥溴水,⑦甲醛,⑧苛性钠溶液,⑨氯化铁溶液,⑩金属钠.前5种物质中有1种跟后5种物质均能反应;后5种物质中有1种跟前5种物质均能反应,则这两种物质分别是( )
查看习题详情和答案>>
(1)以下有机物①CH4②CH2=CH2③CH≡CH④CH3COOH.其中,属于食醋的主要成分的是 (填序号,下同),属于沼气的主要成分的是 ,可以作为植物生长调节剂的是 ,能发生加成反应的是 .
(2)下列5种物质:①CO2②NH3③SO2④H2SO4⑤NaCl.其中,能使品红溶液褪色的是 (填序号,下同),属于电解质的是 ,遇氯化氢有白烟生成的是 ,与氯化钡溶液反应产生白色沉淀的是 .
查看习题详情和答案>>
(2)下列5种物质:①CO2②NH3③SO2④H2SO4⑤NaCl.其中,能使品红溶液褪色的是
请你回答下列问题:
(1)攀枝花地区是我国钒钛磁铁矿的主要成矿带,钒矿资源较多,居世界第3位,钒(V)元素原子的价电子排布图为: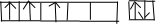
 .钛元素的基态原子的简化电子排布式
.钛元素的基态原子的简化电子排布式
(2)配合物[Cr(NH3)5SO4]Br的中心离子的符号为
(3)有下列四种无机含氧酸:①H3PO4 ②HClO3 ③H3BO3 根据无机含氧酸的酸性规律,将三种无机含氧酸按酸性强弱顺序是
(4)有下列八种物质:①CaCl2晶体 ②干冰 ③NaOH晶体 ④NH4Cl晶体⑤金刚石 ⑥金刚砂晶体.其中含有配位键的离子晶体是
(5)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为
查看习题详情和答案>>
(1)攀枝花地区是我国钒钛磁铁矿的主要成矿带,钒矿资源较多,居世界第3位,钒(V)元素原子的价电子排布图为:


[Ar]3d34s2
[Ar]3d34s2
;(2)配合物[Cr(NH3)5SO4]Br的中心离子的符号为
Cr 3+
Cr 3+
,配位数6
6
.(3)有下列四种无机含氧酸:①H3PO4 ②HClO3 ③H3BO3 根据无机含氧酸的酸性规律,将三种无机含氧酸按酸性强弱顺序是
②①③
②①③
.(4)有下列八种物质:①CaCl2晶体 ②干冰 ③NaOH晶体 ④NH4Cl晶体⑤金刚石 ⑥金刚砂晶体.其中含有配位键的离子晶体是
④
④
;属于分子晶体的是②
②
,含有非极性共价键的原子晶体是⑤
⑤
.(5)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为
δs-p
δs-p
.Cl2分子含有的共价键用符号表示为δp-p
δp-p
.[化学选修3-物质结构与性质]
已知A、B、C、D、E、F是周期表中前四周期的元素,它们的核电荷数依次增大.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的某种氧化物分子为非极性分子,其晶胞中分子呈面心立方堆积.E的电负性在该周期中最大.C的单质是一种常见的半导体材料.回答下列问题:(答题时,A、B、C、D、E、F均用所对应的元素符号表示)
(1)写出基态F原子的核外电子排布式 .
(2)A,B,C的第一电离能由大到小的顺序为 .
(3)上述A的氧化物分子中心原子采取 杂化,其晶胞中微粒间的作用力为 .
(4)有下列三种物质:①B的氢化物②A的最高价氧化物③A和C形成的化合物,它们的沸点从高到低的顺序为 .
(5)固体CrE3?6H2O溶于水可能有几种不同组成的配离子,将含0.2665g CrE3?6H2O 的溶液通过氢离子交换树脂(只交换配阳离子),交换出的氢离子恰好用0.1250mol/L的氢氧化钠溶液8.00mL中和.已知配离子配位数为6,则该配离子是 ,配位原子是 ,该固体溶于水还可形成多种配阳离子,写出其中的两种 .
查看习题详情和答案>>
已知A、B、C、D、E、F是周期表中前四周期的元素,它们的核电荷数依次增大.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的某种氧化物分子为非极性分子,其晶胞中分子呈面心立方堆积.E的电负性在该周期中最大.C的单质是一种常见的半导体材料.回答下列问题:(答题时,A、B、C、D、E、F均用所对应的元素符号表示)
(1)写出基态F原子的核外电子排布式
(2)A,B,C的第一电离能由大到小的顺序为
(3)上述A的氧化物分子中心原子采取
(4)有下列三种物质:①B的氢化物②A的最高价氧化物③A和C形成的化合物,它们的沸点从高到低的顺序为
(5)固体CrE3?6H2O溶于水可能有几种不同组成的配离子,将含0.2665g CrE3?6H2O 的溶液通过氢离子交换树脂(只交换配阳离子),交换出的氢离子恰好用0.1250mol/L的氢氧化钠溶液8.00mL中和.已知配离子配位数为6,则该配离子是