摘要: 本试卷分I.Ⅱ卷.I卷答案用铅笔涂写在答题卡内.Ⅱ卷答案用钢笔或圆珠笔清楚填
网址:http://m.1010jiajiao.com/timu3_id_212386[举报]
KIO3为白色结晶粉末,溶于水,常温下稳定,833K以上分解.目前KIO3的制备方法有两种:
方法一:电解法.工艺流程如下:

(1)配制碱性电解液的过程中,I2会发生氧化还原反应,生成KIO3和
(2)电解时,阳极和阴极的电极方程式分别是:
①阳极:
方法二:氯酸钾氧化法.在酸性条件下,将氯酸钾(KClO3)与I2混合,反应后得到KH(IO3)2,再用KOH中和即得KIO3.有关化学反应方程式为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2
(3)KClO3氧化过程中,还原产物为
(4)与“电解法”相比,“氯酸钾氧化法”的不足之处是(写出两条):
①
查看习题详情和答案>>
方法一:电解法.工艺流程如下:

(1)配制碱性电解液的过程中,I2会发生氧化还原反应,生成KIO3和
KI
KI
(填化学式).(2)电解时,阳极和阴极的电极方程式分别是:
①阳极:
I-+6OH--6e-=IO3-+3H2O
I-+6OH--6e-=IO3-+3H2O
;②阴极:2H2O+2e-=H2↑+2OH-
2H2O+2e-=H2↑+2OH-
.方法二:氯酸钾氧化法.在酸性条件下,将氯酸钾(KClO3)与I2混合,反应后得到KH(IO3)2,再用KOH中和即得KIO3.有关化学反应方程式为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2
(3)KClO3氧化过程中,还原产物为
KCl和Cl2
KCl和Cl2
;每生成6mol KH(IO3)2,反应中转移的电子为60
60
mol.(4)与“电解法”相比,“氯酸钾氧化法”的不足之处是(写出两条):
①
生产过程中有氯气产生,易污染环境、腐蚀设备
生产过程中有氯气产生,易污染环境、腐蚀设备
②KClO3原料利用率不高
KClO3原料利用率不高
.尿素[CO(NH2)2]是首个由无机物人工合成的有机物.工业上合成尿素的反应如下:
2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)△H<0.回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ.2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0
反应Ⅱ.NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2>0
下列示意图1中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) .
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图2所示.
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 .
②为提高尿素的产率,下列可以采取的措施有 .
A.缩小反应容器的容积B.升高温度
C.平衡体系中及时分离出CO(NH2)2D.使用合适的催化剂
③该反应的平衡常数表达式K= ;若升高体系的温度,容器中NH3的体积分数将 (填“增加”、“减小”或“不变”).
④若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则此时v正 v逆(填“>”“=”或“<”),判断理由 .
若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线.

查看习题详情和答案>>
2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)△H<0.回答下列问题:
(1)已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ.2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0
反应Ⅱ.NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2>0
下列示意图1中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号)
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图2所示.
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为
②为提高尿素的产率,下列可以采取的措施有
A.缩小反应容器的容积B.升高温度
C.平衡体系中及时分离出CO(NH2)2D.使用合适的催化剂
③该反应的平衡常数表达式K=
④若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则此时v正
若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线.

单质碘有非常重要的用途,它的制备一般有两种方法:
方法一:海带、海藻燃烧后所得的灰份中含I-,从中获得I-,由 I- 制备 I2.
某研究性学习小组为了从海带中提取碘,设计并进行了以下实验:
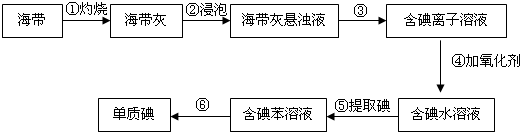
请回答:
(1)步骤①中灼烧海带用到的实验仪器有坩埚钳、铁三脚架、泥三角、酒精灯和 (填字母).
A.试管 B.瓷坩埚 C. 烧杯 D. 量筒
(2)步骤③的实验操作名称是 ;
(3)步骤④中氧化剂最好选用 (填字母)
A.浓硫酸 B.新制氯水
C.酸性KMnO4溶液 D.3%H2O2溶液和稀H2SO4混合液
其反应的离子方程式是 .
(4)步骤⑤中,学生选择用苯来提取碘,还可以用下列 (填字母)来提取碘.
A.乙酸 B.四氯化碳 C.酒精 D.己烷
(5)步骤⑤中,为了检验提取碘后的水溶液中是否还含有单质碘,取少量上述溶液于试管中,滴加 ,如果看到 ,则证明溶液中还含有碘.
(6)步骤⑤中为了得到含碘苯溶液,某学生设计了以下操作步骤:
a.将含碘的水溶液置于分液漏斗中
b.加入适量的苯
c.分离出下层液体
d.分离出上层液体,即得到含碘苯溶液
以上设计中有遗漏的操作.应该在步骤 (填字母)后,增加操作: .
方法二:从智利硝石中获得碘酸钠(NaIO3),再用NaHSO3把碘酸钠还原为I2.实际生产中分两步进行:
第一步:先用适量的 NaHSO3将碘酸钠还原成I-,反应的离子方程式为:
IO3-+3HSO3-=I-+3SO42-+3H+;
第二步:向所得的酸性I-溶液中加入适量的碘酸钠(NaIO3)溶液便有碘析出,反应的离子方程式为 .
查看习题详情和答案>>
方法一:海带、海藻燃烧后所得的灰份中含I-,从中获得I-,由 I- 制备 I2.
某研究性学习小组为了从海带中提取碘,设计并进行了以下实验:

请回答:
(1)步骤①中灼烧海带用到的实验仪器有坩埚钳、铁三脚架、泥三角、酒精灯和
A.试管 B.瓷坩埚 C. 烧杯 D. 量筒
(2)步骤③的实验操作名称是
(3)步骤④中氧化剂最好选用
A.浓硫酸 B.新制氯水
C.酸性KMnO4溶液 D.3%H2O2溶液和稀H2SO4混合液
其反应的离子方程式是
(4)步骤⑤中,学生选择用苯来提取碘,还可以用下列
A.乙酸 B.四氯化碳 C.酒精 D.己烷
(5)步骤⑤中,为了检验提取碘后的水溶液中是否还含有单质碘,取少量上述溶液于试管中,滴加
(6)步骤⑤中为了得到含碘苯溶液,某学生设计了以下操作步骤:
a.将含碘的水溶液置于分液漏斗中
b.加入适量的苯
c.分离出下层液体
d.分离出上层液体,即得到含碘苯溶液
以上设计中有遗漏的操作.应该在步骤
方法二:从智利硝石中获得碘酸钠(NaIO3),再用NaHSO3把碘酸钠还原为I2.实际生产中分两步进行:
第一步:先用适量的 NaHSO3将碘酸钠还原成I-,反应的离子方程式为:
IO3-+3HSO3-=I-+3SO42-+3H+;
第二步:向所得的酸性I-溶液中加入适量的碘酸钠(NaIO3)溶液便有碘析出,反应的离子方程式为
日本福岛第一核电站发生严重的核辐射泄漏后,日本政府向福岛核电站附近居民发放碘片(I-127),以降低放射性碘对人体的伤害.已知核辐射中放射性碘(碘-131)的核电荷数为53,则下列说法不正确的是( )
查看习题详情和答案>>
2005年10月5日,瑞典皇家科学院将本年度诺贝尔化学奖授予法国化学家伊夫·肖万和两位美国化学家罗伯特·格拉布和理查德·施罗克,以表彰他们在烯烃复分解反应研究和应用方面做出的卓越贡献。
伊夫·肖万 罗伯特·格拉布 理查德·施罗克
烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——2-丁烯和乙烯:
现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
请按要求填空:
(1)写出下列反应的反应类型:
③: ,⑥: ,⑧: 。
(2)反应②的化学方程式是: 。
(3)反应④、⑤中有一反应是与HCl加成,该反应是 (填反应编号),设计这一步反应的目的是 ;物质E的结构简式是 。
(4)反应⑩的化学方程式是 。
查看习题详情和答案>>