摘要:除去SO2气体中少量的HCl和水蒸汽 ,应选用试剂 和 , (2)除去NaCl溶液中少量的Na2SO4 , 选用试剂有 . 和稀盐酸, 简述操作顺序 . (3)在证明气体中含有SO2和CO2的实验中.选用试剂有品红.石灰水和 ,气体通入试剂的先后顺序是:
网址:http://m.1010jiajiao.com/timu3_id_212237[举报]
海水是宝贵的自然资源,从海水中可以提取多种化工原料,某工厂对海水综合利用的示意图如下所示:
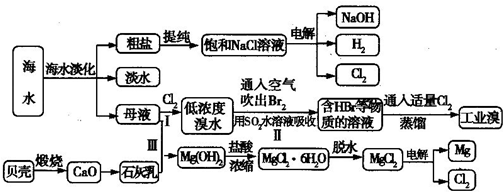
(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是
(2)工业上电解饱和食盐水的离子方程式为
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是
A.H2 B.CO2 C.空气 D.O E.水蒸气.
查看习题详情和答案>>

(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是
②④③①或③②④①或②③④①
②④③①或③②④①或②③④①
(填编号).(2)工业上电解饱和食盐水的离子方程式为
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
富集溴元素;
富集溴元素;
.步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:
Br2+SO2+2H2O=4H++SO42-+2Br-
Br2+SO2+2H2O=4H++SO42-+2Br-
.(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入
氯化镁
氯化镁
溶液,充分搅拌后经过滤
过滤
(填操作方法)可得纯净的Mg(OH)2.(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
.(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是
A
A
(填序号).A.H2 B.CO2 C.空气 D.O E.水蒸气.