摘要: 在足量盐酸中放入7 g含杂质的锌.得到0.2 g氢气.则所含杂质可能为( ) A. B. C. D.
网址:http://m.1010jiajiao.com/timu3_id_2114[举报]
为了测定一瓶久置空气中的氢氧化钠固体中碳酸钠的含量,同学们经过讨论后设计了以下几种方案,请你帮助他们将实验方案填写完整,并对实验方案进行评价。
方案一:通过测定生成二氧化碳气体质量的方法测定碳酸钠的含量。实验设计一:如图1,在圆底烧瓶中放入20 g氢氧化钠样品,通过分液漏斗滴加稀盐酸,至气体不再产生为止,测出量筒内水的体积即为生成的二氧化碳的体积,根据二氧化碳的密度,计算出二氧化碳的质量,从而计算出碳酸钠的含量。
方案一:通过测定生成二氧化碳气体质量的方法测定碳酸钠的含量。实验设计一:如图1,在圆底烧瓶中放入20 g氢氧化钠样品,通过分液漏斗滴加稀盐酸,至气体不再产生为止,测出量筒内水的体积即为生成的二氧化碳的体积,根据二氧化碳的密度,计算出二氧化碳的质量,从而计算出碳酸钠的含量。
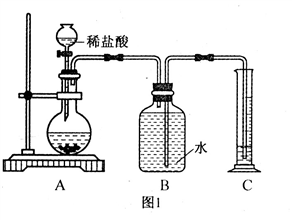
①你认为这种方法________(填“可行”或“不可行”),理由是____________________。 同学们经过讨论,对上述实验方案进行改进,得到了实验设计二。
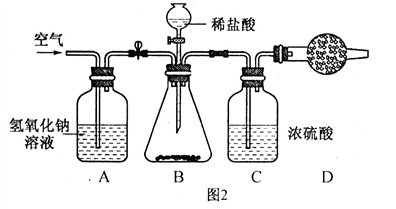
实验设计二:用如图2所示装置,在D装置中装入碱石灰(氢氧化钠和生石灰的混合物)吸收产生的二氧化碳气体,D中增加的质量即为生成的二氧化碳的质量,从而测定出样品中碳酸钠的含量。
实验设计二:用如图2所示装置,在D装置中装入碱石灰(氢氧化钠和生石灰的混合物)吸收产生的二氧化碳气体,D中增加的质量即为生成的二氧化碳的质量,从而测定出样品中碳酸钠的含量。
请你回答:
②A中氢氧化钠溶液的作用是__________________________;C中浓硫酸的作用是___________________________。实验结束时,通入空气的目的是_________________________;如果不通空气,对实验结果的测定是_________________________(填”无影响”、“偏大”或“偏小”)。
③小明认为在D装置的后面再接一个装有碱石灰的干燥管,目的是_______________________________________________________________。
方案二:将20 g样品配制成溶液,在混合溶液中滴加足量的氯化钙溶液或氯化钡溶液与碳酸钠发生反应生成沉淀,将沉淀过滤、洗涤、干燥、称量,即可计算出样品中碳酸钠的含量。
④你认为选择氯化钙溶液或氯化钡溶液中的_____________与碳酸钠发生反应更好,理由是__________________________________________________。 计算:经过滤、洗涤、干燥后,测得沉淀质量为3.94 g,则样品中碳酸钠的含量为_________。
查看习题详情和答案>>
②A中氢氧化钠溶液的作用是__________________________;C中浓硫酸的作用是___________________________。实验结束时,通入空气的目的是_________________________;如果不通空气,对实验结果的测定是_________________________(填”无影响”、“偏大”或“偏小”)。
③小明认为在D装置的后面再接一个装有碱石灰的干燥管,目的是_______________________________________________________________。
方案二:将20 g样品配制成溶液,在混合溶液中滴加足量的氯化钙溶液或氯化钡溶液与碳酸钠发生反应生成沉淀,将沉淀过滤、洗涤、干燥、称量,即可计算出样品中碳酸钠的含量。
④你认为选择氯化钙溶液或氯化钡溶液中的_____________与碳酸钠发生反应更好,理由是__________________________________________________。 计算:经过滤、洗涤、干燥后,测得沉淀质量为3.94 g,则样品中碳酸钠的含量为_________。
写出指定反应的化学方程式,并回答有关问题.
(1)铝片和稀硫酸反应的化学方程式 ,该反应的类型是 反应.
(2)一种燃料电池利用甲烷和氧气在催化剂作用下反应而产生电流,该反应的化学方程式为: .
(3)工人们用盐酸清洗铁制零件表面的铁锈,反应的化学方程式是 .
若将铁制零件较长时间浸在足量盐酸中,对零件的影响是 .
(4)绿色植物光合作用反应的化学方程式是:
(5)稀硫酸和氢氧化钡[Ba(OH)2]溶液混合恰好完全反应,反应的化学方程式为 ,该反应的类型为 反应,混合溶液的导电能力比混合前两种溶液的导电能力 (在“强”、‘‘弱”或“相等”中选填).
查看习题详情和答案>>
(1)铝片和稀硫酸反应的化学方程式
(2)一种燃料电池利用甲烷和氧气在催化剂作用下反应而产生电流,该反应的化学方程式为:
(3)工人们用盐酸清洗铁制零件表面的铁锈,反应的化学方程式是
若将铁制零件较长时间浸在足量盐酸中,对零件的影响是
(4)绿色植物光合作用反应的化学方程式是:
(5)稀硫酸和氢氧化钡[Ba(OH)2]溶液混合恰好完全反应,反应的化学方程式为
写出指定反应的化学方程式,并回答有关问题.
(1)铝片和稀硫酸反应的化学方程式______,该反应的类型是______反应.
(2)一种燃料电池利用甲烷和氧气在催化剂作用下反应而产生电流,该反应的化学方程式为:______.
(3)工人们用盐酸清洗铁制零件表面的铁锈,反应的化学方程式是______.
若将铁制零件较长时间浸在足量盐酸中,对零件的影响是______.
(4)绿色植物光合作用反应的化学方程式是:______
(5)稀硫酸和氢氧化钡[Ba(OH)2]溶液混合恰好完全反应,反应的化学方程式为______,该反应的类型为______反应,混合溶液的导电能力比混合前两种溶液的导电能力______ (在“强”、‘‘弱”或“相等”中选填).
查看习题详情和答案>>
(1)铝片和稀硫酸反应的化学方程式______,该反应的类型是______反应.
(2)一种燃料电池利用甲烷和氧气在催化剂作用下反应而产生电流,该反应的化学方程式为:______.
(3)工人们用盐酸清洗铁制零件表面的铁锈,反应的化学方程式是______.
若将铁制零件较长时间浸在足量盐酸中,对零件的影响是______.
(4)绿色植物光合作用反应的化学方程式是:______
(5)稀硫酸和氢氧化钡[Ba(OH)2]溶液混合恰好完全反应,反应的化学方程式为______,该反应的类型为______反应,混合溶液的导电能力比混合前两种溶液的导电能力______ (在“强”、‘‘弱”或“相等”中选填).