网址:http://m.1010jiajiao.com/timu3_id_210441[举报]
根据信息回答下列问题:
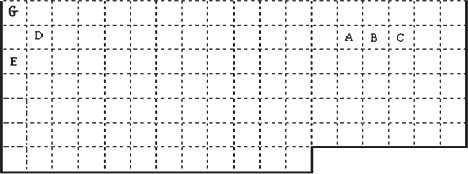
(1)上表中实线是元素周期表的部分边界,请你用实线标出表的上边界,并把符合下列要求的元素的元素符号标在表中对应位置处.
①最高价氧化物的水化物碱性最强(放射性元素除外).
②电负性最大.
③第一电离能对大.
(2)F元素的原子核外有25个运动状态不同的电子,F元素是________(名称),F2+的未成对电子数是________,与F之具有相同最高正价的另一同周期元素的单质在常温下的状态为________.(填固态、液态、气态)
(3)列举一种由A、C、E、G四种元素组成的盐________.
(4)D的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为________、________.
(5)元素M基态原子中次外层有5个未成对电子而最外层只有一个电子;MCl3能与B和C的氢化物共同形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界.MCl3形成的配合物的化学式为________(用具体元素符号表示).
(1)该元素处于元素周期表的第
(2)该元素处于元素周期表的第
(3)该元素处于元素周期表的
(11分)
根据信息回答下列问题:
(1) 上表中实线是元素周期表的部分边界,请你用实线标出表的上边界,并把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)。
② 电负性最大。
③ 第一电离能对大。
(2)F元素的原子核外有25个运动状态不同的电子,F元素是 (名称),F2+的未成对电子数是_____ ,与F之具有相同最高正价的另一同周期元素的单质在常温下的状态为 。(填固态、液态、气态)
(3)列举一种由A、C、E、G四种元素组成的盐 。
(4)D的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________、_____________________________
(5)元素M基态原子中次外层有5个未成对电子而最外层只有一个电子; MCl3能与B和C的氢化物共同形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。MCl3形成的配合物的化学式为_____ ___(用具体元素符号表示)。
(11分)

根据信息回答下列问题:
(1) 上表中实线是元素周期表的部分边界,请你用实线标出表的上边界,并把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)。
② 电负性最大。
③ 第一电离能对大。
(2)F元素的原子核外有25个运动状态不同的电子,F元素是 (名称),F2+的未成对电子数是_____ ,与F之具有相同最高正价的另一同周期元素的单质在常温下的状态为 。(填固态、液态、气态)
(3)列举一种由A、C、E、G四种元素组成的盐 。
(4)D的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________、_____________________________
(5)元素M基态原子中次外层有5个未成对电子而最外层只有一个电子; MCl3能与B和C的氢化物共同形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。MCl3形成的配合物的化学式为_____ ___(用具体元素符号表示)。
查看习题详情和答案>>

(1) 上表中实线是元素周期表的部分边界,请你用实线标出表的上边界,并把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)。
② 电负性最大。
③ 第一电离能对大。
(2)F元素的原子核外有25个运动状态不同的电子,F元素是__________(名称),F2+的未成对电子数是_____ ,与F之具有相同最高正价的另一同周期元素的单质在常温下的状态为___________。(填固态、液态、气态)
(3)列举一种由A、C、E、G四种元素组成的盐____________ 。
(4)D的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_________________、______________。
(5)元素M基态原子中次外层有5个未成对电子而最外层只有一个电子; MCl3能与B和C的氢化物共同形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。MCl3形成的配合物的化学式为________(用具体元素符号表示)。