摘要:对离子晶体而言.“NaCl 其实是个“最简比例式 .以下关于NaCl晶体成分的表达式中比较合理的是 . (A)Na6Cl6 (B)Na6Cl (C)NaCl6 n
网址:http://m.1010jiajiao.com/timu3_id_209473[举报]
大多数离子晶体易溶于______中,难溶于____(如汽油、煤油)中。当把离子晶体放在水中时,极性水分子对离子晶体中的离子产生______,使晶体中的离子克服了____而电离,变成在水中自由移动的________。
查看习题详情和答案>>
下列叙述不正确的是( )
| A、原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 | B、向煤中加入生石灰可减少对大气的污染 | C、完全由非金属元素组成的化合物可以形成离子化合物 | D、由氮气为原料合成氨是氮的固定 |
 (2012?西安一模)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
(2012?西安一模)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.(1)写出A元素的基态原子价电子排布式
2s22p4
2s22p4
;F离子电子排布式1s22s22p63s23p6
1s22s22p63s23p6
.(2)写出X的化学式
Na3AlF6
Na3AlF6
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:
氯化铝为分子晶体,氧化铝为原子晶体,用氧化铝冶炼铝消耗能量大
氯化铝为分子晶体,氧化铝为原子晶体,用氧化铝冶炼铝消耗能量大
.(4)CE、FA的晶格能分别为786KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是:
晶格能与离子的电荷呈正比,电荷越多,晶格能越大,钙离子、氧离子电荷大于钠离子、氯离子电荷
晶格能与离子的电荷呈正比,电荷越多,晶格能越大,钙离子、氧离子电荷大于钠离子、氯离子电荷
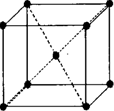
.(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为
CaF2
CaF2
;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是| 4×78g/mol |
| ag/cm3.6.02×1023/mol |
| 4×78g/mol |
| ag/cm3.6.02×1023/mol |
 (2011?商丘二模)[选修物质结构与性质]已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态.(答题时用ABCDE对应的元素符号表示)
(2011?商丘二模)[选修物质结构与性质]已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态.(答题时用ABCDE对应的元素符号表示)(1)A的氢化物A2H2分子的空间构型为
直线形
直线形
,其中心原子采取的杂化形式为SP
SP
,分子中含有3
3
个σ键,2
2
π键.(2)写出化合物DC的电子式
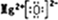
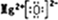
1S22S22P63S23P63d64S2
1S22S22P63S23P63d64S2
.(3)由E元素形成的金属的晶胞结构如图,则该晶胞中含有金属原子的数目为
2
2
.(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于
分子晶体
分子晶体
(填晶体类型).