摘要:12.某同学在实验室进行甲.乙.丙.丁4组实验:各取40mL同浓度的盐酸.加入同一种镁铝合金粉末.合金质量和生成气体体积记录如下表: 实验序号 甲 乙 丙 丁 合金质量(g) 0.204 0.306 0.408 0.510 生成气体体积(mL) 224 336 448 448 请回答: (1)盐酸的物质的量浓度为 mol/L. (2)乙组合金中镁的质量是 g. (3)若在甲组实验后的溶液中加入浓度为0.5mol/L NaOH溶液.使产生的沉淀恰好溶解.则需溶液的体积为 mL.
网址:http://m.1010jiajiao.com/timu3_id_207617[举报]
某同学在实验室进行甲、乙、丙、丁4组实验:各取40mL同浓度的盐酸,加入同一种镁铝合金粉末,合金质量和生成气体体积记录如表:
请回答:
(1)盐酸的物质的量浓度为
(2)乙组合金中镁的质量是
(3)若在甲组实验后的溶液中加入浓度为0.5mol/L NaOH溶液,使产生的Al(OH)3沉淀恰好溶解,则需NaOH溶液的体积为
查看习题详情和答案>>
| 实验序号 | 甲 | 乙 | 丙 | 丁 |
| 合金质量(g) | 0.204 | 0.306 | 0.408 | 0.510 |
| 生成气体体积(mL) (标准状况) |
224 | 336 | 448 | 448 |
(1)盐酸的物质的量浓度为
1
1
mol/L.(2)乙组合金中镁的质量是
0.144
0.144
g.(精确到0.001)(3)若在甲组实验后的溶液中加入浓度为0.5mol/L NaOH溶液,使产生的Al(OH)3沉淀恰好溶解,则需NaOH溶液的体积为
88
88
mL.某同学在实验室进行甲、乙、丙、丁4组实验:各取40mL同浓度的盐酸,加入同一种镁铝合金粉末,合金质量和生成气体体积记录如表:
| 实验序号 | 甲 | 乙 | 丙 | 丁 |
| 合金质量(g) | 0.204 | 0.306 | 0.408 | 0.510 |
| 生成气体体积(mL) (标准状况) | 224 | 336 | 448 | 448 |
(1)盐酸的物质的量浓度为______mol/L.
(2)乙组合金中镁的质量是______g.(精确到0.001)
(3)若在甲组实验后的溶液中加入浓度为0.5mol/L NaOH溶液,使产生的Al(OH)3沉淀恰好溶解,则需NaOH溶液的体积为______mL. 查看习题详情和答案>>
某同学在实验室进行甲、乙、丙、丁4组实验:各取40mL同浓度的盐酸,加入同一种镁铝合金粉末,合金质量和生成气体体积记录如表:
请回答:
(1)盐酸的物质的量浓度为______mol/L.
(2)乙组合金中镁的质量是______g.(精确到0.001)
(3)若在甲组实验后的溶液中加入浓度为0.5mol/L NaOH溶液,使产生的Al(OH)3沉淀恰好溶解,则需NaOH溶液的体积为______mL.
查看习题详情和答案>>
| 实验序号 | 甲 | 乙 | 丙 | 丁 |
| 合金质量(g) | 0.204 | 0.306 | 0.408 | 0.510 |
| 生成气体体积(mL) (标准状况) | 224 | 336 | 448 | 448 |
(1)盐酸的物质的量浓度为______mol/L.
(2)乙组合金中镁的质量是______g.(精确到0.001)
(3)若在甲组实验后的溶液中加入浓度为0.5mol/L NaOH溶液,使产生的Al(OH)3沉淀恰好溶解,则需NaOH溶液的体积为______mL.
查看习题详情和答案>>
在实验室中,为验证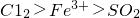 的氧化性顺序,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已省略,气密性已经检验).
的氧化性顺序,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已省略,气密性已经检验).
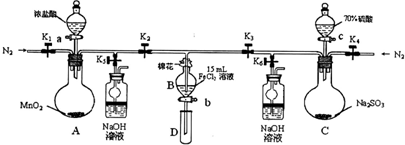
(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是______.
(2)关闭K1、K3、K4,打开活塞a,滴加一定量的浓盐酸,给A加热,A中发生反应的离子方程式为______.
(3)当B中的溶液变黄时,停止加热,夹紧弹簧夹K2并打开K5,这样做的原因是______.
(4)打开活塞b,使约2mL的溶液流入试管D中,滴入______可以证明其中是否含有Fe3+离子.
(5)打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3并打开K6,用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______.
(6)更新试管D,打开活塞b,使约2mL的溶液流入试管D中,检验B溶液中的离子.检验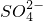 所需的试剂是______.
所需的试剂是______.
A.Ba(NO3)2溶液 B.BaC12溶液 C.AgNO3溶液 D.Ba(OH)2溶液
甲、乙、丙三位同学分别对两次B中得到的溶液进行了有关离子的检测,他们的检测结果一定能够证明氧化性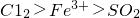 的是______.
的是______.
| 第一次B中溶液含有离子 | 第二次B中溶液含有离子 | |
| 甲 | 有Fe2+,无Fe3+ | 有SO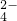 |
| 乙 | 既有Fe3+,又有Fe2+ | 有SO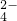 |
| 丙 | 有Fe3+,无Fe2+ | 有Fe2+ |
 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
稀H2SO4与Cu不反应
稀H2SO4与Cu不反应
、随着反应进行,H2SO4越来越稀,所以H2SO4一定有剩余
随着反应进行,H2SO4越来越稀,所以H2SO4一定有剩余
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入NaNO3、Fe2O3
NaNO3、Fe2O3
(填写两种属于不同类别的物质).(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量
4
4
次.②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
偏大
偏大
(填“偏大”或“偏小”).(3)装置乙的作用是:
防止丙中液体倒吸入甲中
防止丙中液体倒吸入甲中
;(4)下列说法正确的是:
bdf
bdf
(填序号).a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气.