摘要: 分析:在4Fe3+ + 2H2O 4Fe2+ + 4H+ + O2↑反应中.每生成标准状况下22.4LO2.电子转移的个数为----------------------( ) A.6.02×1023 B.1. 806×1024 C.1.204×1024 D.2.408×1024
网址:http://m.1010jiajiao.com/timu3_id_207195[举报]
不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在近20年来植物生理学.生态学和环境科学研究中获得广泛应用.如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物.下列有关说法正确的是( )
查看习题详情和答案>>
不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用.如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物.下列说法中正确的是( )
查看习题详情和答案>>
(2010?烟台一模)不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在科学研究中获得了广泛的应用.如2H、13C、15N、18O、34S等常用作环境分析指示物.下列有关说法正确的是( )
查看习题详情和答案>>
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
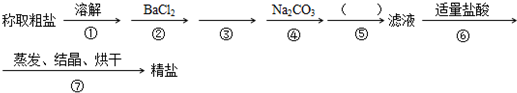
(1)判断BaCl2已过量的方法是
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(3)在 中 填写所使用除杂试剂的化学式
中 填写所使用除杂试剂的化学式
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是:
查看习题详情和答案>>

(1)判断BaCl2已过量的方法是
取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可)
取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可)
.(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl
.(3)在
 中 填写所使用除杂试剂的化学式
中 填写所使用除杂试剂的化学式NaOH
NaOH
,在 ( )中的操作名称是过滤
过滤
.(4)从实验设计方案优化的角度分析步骤②和④可否颠倒
否
否
(填“是”或“否”,如果“否”,请说明理由.)原因是:过量的BaCl2必须要用Na2CO3除去,步骤复杂
过量的BaCl2必须要用Na2CO3除去,步骤复杂
;步骤③和④可否颠倒是
是
.(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是:
会有部分沉淀溶解,从而影响制得精盐的纯度
会有部分沉淀溶解,从而影响制得精盐的纯度
.