摘要:14.为了除去CO2中含有少量的HCl 气体.可以使气体通过 A.Na2CO3溶液 B.饱和NaHCO3溶液 C.H2SO4溶液 D.Ba(OH)2溶液
网址:http://m.1010jiajiao.com/timu3_id_207074[举报]
(1)某化工厂排出的废水中含有Cl2和H2SO4,为了除去此废水中的游离氯,并使废水变为中性,供使用的试剂有Na2CO3溶液和Na2SO3溶液。试完成下列问题:
①应先向废水中加入________溶液,离子方程式为________________________。
②然后向废水中加入________溶液,离子方程式为________________________。
(2)有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种。将气体通入适量氯水中,得到无色透明溶液,继续向该溶液中加入少量的BaCl2溶液和盐酸,则产生白色沉淀。原气体中肯定含有______,肯定不含有______,可能含有______。
查看习题详情和答案>>温州市地处沿海,海水资源丰富,海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO.盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等.制备流程如图1:
(1)滤渣的成分是
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
(3)温度和压强P(HCl)g对MgCl2?6H2O晶体热分解产物的影响如图2所示.请回答下列问题:
①写出P(HCl)g=0.25MPa,温度从300℃升高到550℃时反应的化学方程式
②实际生产中,将MgCl2?6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
查看习题详情和答案>>

(1)滤渣的成分是
Fe(OH)3、CaSO4
Fe(OH)3、CaSO4
(写化学式);滤液Ⅱ中所含主要的杂质离子是Na+
Na+
(写离子符号).为了加快过滤速度,常采用减压过滤,写出组装减压过滤装置的主要硅酸盐仪器名称布氏漏斗
布氏漏斗
,抽滤瓶或吸滤瓶
抽滤瓶或吸滤瓶
.(写2种即可)(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O
3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O
;加入NaClO的另一个作用是将Fe2+氧化为Fe3+,并形成Fe(OH)3被除去.
将Fe2+氧化为Fe3+,并形成Fe(OH)3被除去.
.(3)温度和压强P(HCl)g对MgCl2?6H2O晶体热分解产物的影响如图2所示.请回答下列问题:
①写出P(HCl)g=0.25MPa,温度从300℃升高到550℃时反应的化学方程式
Mg(OH)Cl=MgO+HCl↑
Mg(OH)Cl=MgO+HCl↑
;②实际生产中,将MgCl2?6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
P(HCl)g较小,镁离子水解生成氢氧化镁,得不到氯化镁;通入HCl,而增大P(HCl)g
P(HCl)g较小,镁离子水解生成氢氧化镁,得不到氯化镁;通入HCl,而增大P(HCl)g
;若要得到无水MgCl2须采取的措施是通入HCl,而增大P(HCl)g,抑制镁离子的水解;
通入HCl,而增大P(HCl)g,抑制镁离子的水解;
.(2013?湛江二模)为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置.回答下列问题:

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃.甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式
(2)乙同学认为无论反应原理如何,最终都有O2产生.乙同学的理由是
按照乙同学的观点,该装置需作的改进是:
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:
①Na2SO3; ②Na2SO4; ③Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2mol?L-1 HCl,1mol?L-1HNO3,1mol?L-1 BaCl2,1mol?L-1 Ba(NO3)2,
(0.01mol?L-1KMnO4酸性溶液.)
(4)生成物中亚硫酸钠含量的测定:①取a克生成物配制成100ml溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.0100mol?L-1碘水进行滴定,滴定终点现象为
②计算:生成物中亚硫酸钠的质量分数为
查看习题详情和答案>>

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃.甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式
SO2+Na2O2=Na2SO4
SO2+Na2O2=Na2SO4
.(2)乙同学认为无论反应原理如何,最终都有O2产生.乙同学的理由是
A中生成的SO2气体中含有水蒸气
A中生成的SO2气体中含有水蒸气
.按照乙同学的观点,该装置需作的改进是:
在A和B之间连接一个装有浓硫酸的洗气瓶
在A和B之间连接一个装有浓硫酸的洗气瓶
.(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:
①Na2SO3; ②Na2SO4; ③Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2mol?L-1 HCl,1mol?L-1HNO3,1mol?L-1 BaCl2,1mol?L-1 Ba(NO3)2,
(0.01mol?L-1KMnO4酸性溶液.)
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中. | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 足量的1 mol?L-1盐酸 足量的1 mol?L-1盐酸 ,再滴加1 mol?L-1 BaCl2溶液 1 mol?L-1 BaCl2溶液 . |
有白色沉淀生成 有白色沉淀生成 ,则证明生成物中含Na2SO4. |
| 步骤3:往Ⅱ试管中 2~3滴0.01mol?L-1KMnO4酸性溶液,振荡 2~3滴0.01mol?L-1KMnO4酸性溶液,振荡 删除此空 删除此空 . |
若 KMnO4溶液紫红色褪去 KMnO4溶液紫红色褪去 ,则说明生成物中有Na2SO3;若 KMnO4溶液紫红色不褪去 KMnO4溶液紫红色不褪去 删除此空 删除此空 ,则说明生成物中没有Na2SO3. |
溶液出现蓝色,且半分钟内不褪去
溶液出现蓝色,且半分钟内不褪去
,记录数据,重复滴定2次,平均消耗碘水20.00mL.②计算:生成物中亚硫酸钠的质量分数为
0.252/a
0.252/a
.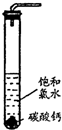 实验一、定性探究:
实验一、定性探究:①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因
在饱和氯水中存在如下平衡:Cl2+H2O HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
 HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO在饱和氯水中存在如下平衡:Cl2+H2O HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
. HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:
Ca2++HCO3-+OH-=CaC03↓+H2O
Ca2++HCO3-+OH-=CaC03↓+H2O
.第二份:
HCO3-+H+=CO2↑+H2O
HCO3-+H+=CO2↑+H2O
.(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)
HClO、Ca(HCO3)2、CaCl2
HClO、Ca(HCO3)2、CaCl2
.实验二、定量探究:
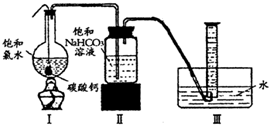
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为
B
B
.A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液 C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现
| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |
碳酸钙与氯水反应生成的Ca(HC03)2再受热时,除生成CO2外,还生成了CaC03
碳酸钙与氯水反应生成的Ca(HC03)2再受热时,除生成CO2外,还生成了CaC03
.海水是宝贵的自然资源,从海水中可以提取多种化工原料,某工厂对海水综合利用的示意图如下所示:
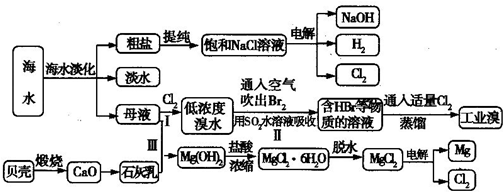
(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是
(2)工业上电解饱和食盐水的离子方程式为
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是
A.H2 B.CO2 C.空气 D.O E.水蒸气.
查看习题详情和答案>>

(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是
②④③①或③②④①或②③④①
②④③①或③②④①或②③④①
(填编号).(2)工业上电解饱和食盐水的离子方程式为
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
富集溴元素;
富集溴元素;
.步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:
Br2+SO2+2H2O=4H++SO42-+2Br-
Br2+SO2+2H2O=4H++SO42-+2Br-
.(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入
氯化镁
氯化镁
溶液,充分搅拌后经过滤
过滤
(填操作方法)可得纯净的Mg(OH)2.(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
.(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是
A
A
(填序号).A.H2 B.CO2 C.空气 D.O E.水蒸气.