网址:http://m.1010jiajiao.com/timu3_id_206704[举报]
工业品纯碱中常含有少量的NaCl等杂质,图中的仪器装置可用来测定纯碱中![]() 的质量分数,图中标号:①空气,②某溶液,③纯碱样品,④稀
的质量分数,图中标号:①空气,②某溶液,③纯碱样品,④稀 ,⑤浓
,⑤浓 ,⑥碱石灰,⑦碱石灰.
,⑥碱石灰,⑦碱石灰.

实验步骤是:
①检查装置的气密性;
②准确称量盛有碱石灰干燥管Ⅰ的质量(设为 );
);
③准确称量一定量的纯碱的质量(设为 ),并将其放入广口瓶中;
),并将其放入广口瓶中;
④从分液漏斗中缓滴入稀![]() ,至不再产生气体为止;
,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为 ).
).
根据上述实验,回答下列问题:
(1)鼓入空气的目的是___________________________________.
(2)装置A中液体②应为_________,其作用是__________,如撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将_________(填“偏大”、“偏小”或“不变”).
(3)装置C的作用是_____,如果撤去装置C,则会导致实验结果________(填“偏大”、“偏小”或“不变”).
(4)干燥管Ⅱ的作用是____________________________________.
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是________,如果这两步操作太快,则会导致实验测定结果_______(填“偏大”、“偏小”或“不变”).
(6)根据实验,纯碱中![]() 的质量分数的计算式为__________.
的质量分数的计算式为__________.
工业品纯碱中常含有少量的NaCl等杂质,图中的仪器装置可用来测定纯碱中![]() 的质量分数,图中标号:①空气,②某溶液,③纯碱样品,④稀
的质量分数,图中标号:①空气,②某溶液,③纯碱样品,④稀 ,⑤浓
,⑤浓 ,⑥碱石灰,⑦碱石灰.
,⑥碱石灰,⑦碱石灰.

实验步骤是:
①检查装置的气密性;
②准确称量盛有碱石灰干燥管Ⅰ的质量(设为 );
);
③准确称量一定量的纯碱的质量(设为 ),并将其放入广口瓶中;
),并将其放入广口瓶中;
④从分液漏斗中缓滴入稀![]() ,至不再产生气体为止;
,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为 ).
).
根据上述实验,回答下列问题:
(1)鼓入空气的目的是___________________________________.
(2)装置A中液体②应为_________,其作用是__________,如撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将_________(填“偏大”、“偏小”或“不变”).
(3)装置C的作用是_____,如果撤去装置C,则会导致实验结果________(填“偏大”、“偏小”或“不变”).
(4)干燥管Ⅱ的作用是____________________________________.
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是________,如果这两步操作太快,则会导致实验测定结果_______(填“偏大”、“偏小”或“不变”).
(6)根据实验,纯碱中![]() 的质量分数的计算式为__________.
的质量分数的计算式为__________.
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了两种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
【方案二】用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量样品W1 g并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量沉淀W2 g并进行恒重操作,最后称量沉淀W3 g.
称量时所需定量实验仪器为______.根据方案一的数据,算出样品中纯碱的质量分数为______(用代数式表示).
(2)方案二的实验装置如图:
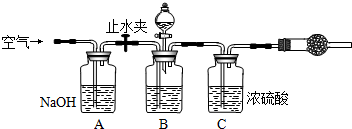
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④缓缓鼓入空气数分钟;⑤关闭止水夹,缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.
根据方案二的数据,算出样品中纯碱的质量分数为______(用代数式表示).图中装置A的作用是______.装置C的作用是______.如果没有装置A和实验操作④⑦,会导致测量结果______(填“偏大”、“偏小”或“无影响”).有同学认为空气中的水蒸气会进入干燥管导致测量结果______(填“偏大”、“偏小”或“无影响”),改进措施可以是______.
查看习题详情和答案>>
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
【方案二】用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量样品W1 g并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量沉淀W2 g并进行恒重操作,最后称量沉淀W3 g.
称量时所需定量实验仪器为______.根据方案一的数据,算出样品中纯碱的质量分数为______(用代数式表示).
(2)方案二的实验装置如图:
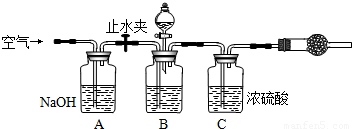
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④缓缓鼓入空气数分钟;⑤关闭止水夹,缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.
根据方案二的数据,算出样品中纯碱的质量分数为______(用代数式表示).图中装置A的作用是______.装置C的作用是______.如果没有装置A和实验操作④⑦,会导致测量结果______(填“偏大”、“偏小”或“无影响”).有同学认为空气中的水蒸气会进入干燥管导致测量结果______(填“偏大”、“偏小”或“无影响”),改进措施可以是______.
查看习题详情和答案>>