网址:http://m.1010jiajiao.com/timu3_id_206339[举报]
有一部分被氧化的钠块(氧化部分生成![]() 和
和![]() )5g,与水完全反应,生成气体为1.12L(标准状况),将这些气体引燃后冷却到标准状况,剩余气体为0.336L.求钠块中单质钠、氧化钠、过氧化钠各多少克?
)5g,与水完全反应,生成气体为1.12L(标准状况),将这些气体引燃后冷却到标准状况,剩余气体为0.336L.求钠块中单质钠、氧化钠、过氧化钠各多少克?
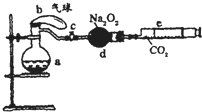 (2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占
(2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占| 1 | 5 |
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有剩余(设产生的气体不溶解于溶液中),则可观察到的现象是
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施.若用加入化学试剂法,下列试剂中可以选用的是
A.蒸馏水 B.无水醋酸钠 C.铜粉 D.少量硝酸银溶液
(3)将烧瓶不断振荡发现气球逐渐缩小,反应的化学方程式是
(4)打开弹簧夹c,将二氧化碳推入干燥管内,继续振荡烧瓶,使气体与气体、溶液充分接触,欲使所有的铜粉全溶解,至少需要推入二氧化碳
(5)将上述过程用一个总的化学方程式表示
(2)用酒精灯火焰加热金属铝箔(已除氧化膜)产生的实验现象是
(3)某实验探究小组在进行了上述两个实验后,为了探究两者实验现象的不同,提出了如下假设:
①金属镁和铝的着火点不同;
②金属镁和铝的熔点不同;
③金属镁和铝的沸点不同;
④金属镁和铝在空气或氧气中燃烧的燃烧热不同.
随后他们进行了如下的探究:
【查阅资料】
Ⅰ.几种物质的熔沸点和镁铝的燃烧热
| Mg | Al | MgO | Al2O3 | |
| 熔点/℃ | 648.8 | 660.4 | 2852 | 2072 |
| 沸点/℃ | 1107 | 2467 | 3600 | 2980 |
| 燃烧热*/kJ?mol-1 | 601.8 | 833.6 |
Ⅱ.可燃性固体没有固定的着火点(燃点),其着火点的高低与固体颗粒的大小有关,固体颗粒越小,
【原因探析】
A.镁和铝的熔点很接近且实验所用的是镁条和铝箔,加热它们产生的实验现象不同不可能是由
B.若只从反应生成氧化物放出的热量来分析,应该是
C.若只从镁、铝及其氧化物的熔点和燃烧热来分析,用酒精灯火焰加热镁条(已除氧化膜)的实验现象应是
D.用酒精灯火焰加热铝箔(已除氧化膜)产生实验现象的主要原因是
E.镁条能燃烧,铝箔不能燃烧的主要原因是由
若X、 Y两种元素在周期表中位于同一主族,且相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平): Xm + Yn + H2O → HXO3 + HY
请回答:(1)该反应的还原剂的电子式为___________________。
(2)配平上述化学方程式(用化学式表示):
(3)若某化学反应如下:(未配平)
KX + Yn + H2O → KXO3 + Xm + HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目
KX + Yn + H2O →
(4)已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:

①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中生成NaYO3的歧化反应的离子方程式为(用化学式表示): ____________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。已知有2L 3mol/L的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1mol/L。(已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变 )、
查看习题详情和答案>>若X、Y两种元素在周期表中位于同一主族,其中一种为短周期元素,且两者相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):
Xm + Yn + H2O → HXO3 + HY。请回答:
⑴该反应的还原剂的电子式为___________________。
⑵配平上述化学方程式(用化学式表示):
⑶若某化学反应如下:(未配平)KX + Yn + H2O → KXO3 + Xm + HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目:
KX + Yn + H2O →
⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中由NaYO歧化生成NaYO3的离子方程式为(用化学式表示):______________________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。在2L 3 mol·L-1的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1 mol·L-1。[已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变]
查看习题详情和答案>>