网址:http://m.1010jiajiao.com/timu3_id_204686[举报]
(1)实验室制取氨气的化学方程式是 。
(2)工业上氨气可以由氢气和氮气合成。

①该反应的热化学方程式是 。
②简述一种检查氨气是否泄露可采用的化学方法: 。
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
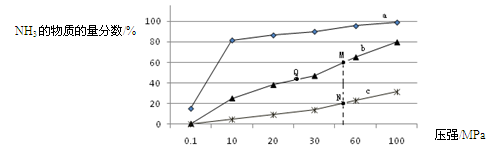
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③ M点对应的H2转化率是 。
(4)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用
氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶
质为 。
② (NH4)2SO3显碱性,用化学平衡原理解释 。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确
的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(5)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是 ,正极的电极反应方是 。
 ),可用淀粉发酵法生产.
),可用淀粉发酵法生产.(1)发酵法第一步是使淀粉水解.实验室中淀粉在酸性条件下水解为单糖的化学方程式是
| 酸 |
| 酸 |
a.NaOH溶液、氨水、AgNO3溶液 b.H2SO4溶液、碘水
c.NaOH溶液、CuSO4溶液 d.H2SO4溶液、CuSO4溶液
(2)测定味精中谷氨酸一钠盐的含量:将一定质量味精样品溶于水,向所得溶液中加入甲醛溶液(发生反应:-NH2+HCHO→-N=CH2+H2O),再以酚酞为指示剂,用NaOH溶液进行滴定.上述测定过程中加入甲醛的目的是
(3)味精中常含食盐,现设计方案测定味精中NaCl的含量(味精中的其他成分和指示剂的用量对测定结果无影响):取m g味精溶于水,加入过量c1mol?L-1 AgNO3溶液,再加入少量含Fe3+的溶液作指示剂,用c2 mol?L-1 NH4SCN溶液进行滴定(AgSCN为白色难溶物),溶液最终变为红色时,达到滴定终点.重复上述测定过程3次,测得消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1 mL和V2 mL.
①用上述方法测得该味精样品中NaCl的质量分数是
| 5.85(c1V1-c2V2) |
| m |
| 5.85(c1V1-c2V2) |
| m |
②若实验操作无误差,测定结果低于实际值.用平衡移动原理解释结果偏低的可能原因是
回答下列问题。
(1)常温时,FeCl3 溶液的pH 7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是 ;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是 。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是 。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是 ,该溶液中四种离子的浓度由大到小的顺序为 。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为 。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) c(CH3COOH)(填“>”、“<”或“=”)。
查看习题详情和答案>>
回答下列问题。
(1)常温时,FeCl3溶液的pH 7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是 ;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是 。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是 。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是 ,该溶液中四种离子的浓度由大到小的顺序为 。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为 。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) c(CH3COOH)(填“>”、“<”或“=”)。
(1)常温时,FeCl3溶液的pH 7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是 ;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是 。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是 。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是 ,该溶液中四种离子的浓度由大到小的顺序为 。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为 。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) c(CH3COOH)(填“>”、“<”或“=”)。