摘要:A是某工厂废旧铁制机械表面上红色固体的主要成分.B.C.F都是单质.D.F都是无色无味的气体.它们之间的转化关系如下: 请回答: (1)写出下列物质的化学式:CFe,FH2. (2)写出气体D和过量澄清石灰水反应的化学方程式:CO2+Ca(OH)2=CaCO3+H2O. (3)分别写出①.②反应的反应类型:①置换反应,②置换反应. (4)写出与A的组成元素相同的其他化合物的化学式:FeO,Fe3O4.
网址:http://m.1010jiajiao.com/timu3_id_203490[举报]
A是某工厂废旧机械表面上红色固体的主要成分,B、C、F都是单质,D、F都是无色无味的气体,它们之间的相互转化关系如下图:
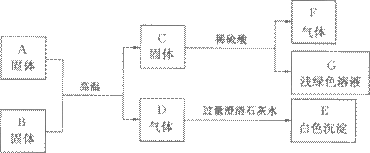
请回答:
(1)写出下列物质的化学式:
C____________,F___________,B__________,G的溶质____________。
(2)写出图中气体D和澄清石灰水反应相应的化学方程式:______________________
查看习题详情和答案>>A是某工厂废旧机械表面上红色固体的主要成分,B、C、F都是单质,D、F都是无色无味的气体,它们之间的相互转化关系如下图:
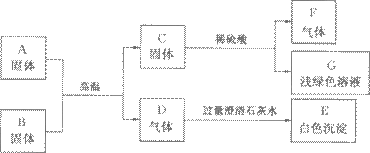
请回答:
(1)写出下列物质的化学式:
C____________,F___________,B__________,G的溶质____________。
(2)写出图中气体D和澄清石灰水反应相应的化学方程式:______________________
查看习题详情和答案>>A是某工厂废旧机械表面上红色固体的主要成分Fe2O3,B、C、F都是单质,D、F都是无色无味的气体,它们之间的相互转化关系如下图所示:
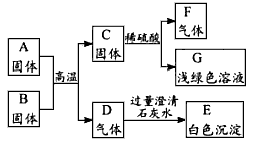
请回答:
(1)写出下列物质的化学式:C___,F___。
(2)写出气体D和过量澄清石灰水反应的化学方程式:___。
查看习题详情和答案>>
(1)写出下列物质的化学式:C___,F___。
(2)写出气体D和过量澄清石灰水反应的化学方程式:___。
(2010?南宁一模)已知A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体且D显淡黄色.E、F、G、H、I为五种化合物,E为气体且极易溶于水成为无色溶液,F不溶于水,G溶于水得黄棕色溶液.这九种物质间反应的转化关系如图所示:

(I)写出四种单质的化学式
A
(2)用电子式表示E的形成过程
 ;化台物I的晶体类型为
;化台物I的晶体类型为
(3)写出G+I→H+D+E的化学方程式
(4)某工厂用B制漂白粉.为测定该工厂制得的漂白粉中有效成分的含量,兴趣小组的同学进行了如下实验:称取漂白粉样品2.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
查看习题详情和答案>>

(I)写出四种单质的化学式
A
H2
H2
,BCl2
Cl2
,CFe
Fe
,DS
S
.(2)用电子式表示E的形成过程


分子晶体
分子晶体
其空间构型为V型
V型
.(3)写出G+I→H+D+E的化学方程式
2FeCl3+H2S═2FeCl2+S↓+2HCl
2FeCl3+H2S═2FeCl2+S↓+2HCl
.(4)某工厂用B制漂白粉.为测定该工厂制得的漂白粉中有效成分的含量,兴趣小组的同学进行了如下实验:称取漂白粉样品2.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
2I-+ClO-+2H+=I2+Cl-+H2O
2I-+ClO-+2H+=I2+Cl-+H2O
.静置,待完全反应后,用0.1mol?L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00ml.则该漂白粉样品中有效成分的质量分数为35.75%
35.75%
(保留到小数点后两位).海水是一种丰富的资源,工业上从海水中可提取NaCl、Na2CO3、Mg等多种物质,这些物质广泛应用于生产、生活等领域.如图所示是某工厂对海水资源进行综合利用的流程.

请回答下列问题:
(1)流程图中操作a的名称为
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A应是
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上常向滤液D中通入NH3,并加入细小食盐颗粒,使溶液冷却,析出不含有NaHCO3副产品的NH4Cl晶体,通入NH3的作用是
(3)操作b应在
(4)某氯碱厂每天消耗234吨NaCl,可生产质量分数为32%的烧碱溶液
查看习题详情和答案>>

请回答下列问题:
(1)流程图中操作a的名称为
蒸发结晶
蒸发结晶
.(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A应是
NH3
NH3
(填化学式),此过程的化学方程式为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓
NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓
.②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上常向滤液D中通入NH3,并加入细小食盐颗粒,使溶液冷却,析出不含有NaHCO3副产品的NH4Cl晶体,通入NH3的作用是
增大NH4+的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度
增大NH4+的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度
.(3)操作b应在
HCl
HCl
气流中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式:MgCl2?6H2O
Mg(OH)Cl+HCl↑+5H2O
| ||
MgCl2?6H2O
Mg(OH)Cl+HCl↑+5H2O
.
| ||
(4)某氯碱厂每天消耗234吨NaCl,可生产质量分数为32%的烧碱溶液
500
500
吨.