网址:http://m.1010jiajiao.com/timu3_id_203323[举报]
(1)第一次实验中,钠球在水面上游动,其原因是________________________;第二次实验中,实验前先要将塑料瓶挤瘪,这样做的目的是________________________________。
(2)某研究性学习小组拟用下图的实验装置进行钠跟水的反应实验,并收集、检验生成的气体。Na的密度为0.97 g·cm-3,煤油的密度为0.87 g·cm-3。请完成下列问题:
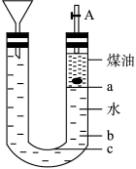
①液体物质添加完毕后,关闭活栓,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在________处(填a、b、c)。
②反应后,钠在煤油层和水层面之间上下跳动,反应平缓连续进行。说明产生上述现象的原因________________________________。
③写出Na跟水反应的离子方程式________________________________。
④装置中的漏斗在反应过程中的主要作用是________________________________。
⑤本实验除能使反应连续进行、收集并检验气体外,还有一个优点是______。这是因为________________________________。
查看习题详情和答案>>用中学常备的实验仪器,设计一个实验,证实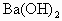 与
与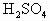 在溶液中的反应是离子反应,并回答下列问题.
在溶液中的反应是离子反应,并回答下列问题.
(1)实验所需仪器有________.连接好装置
(2)开始实验:①反应前可以看到________说明________ .②反应开始至一段时间,可以看到________,说明________.③ 当两种反应物完全反应时,可以看到________,说明________.④继续操作,可以看到________,说明________.
查看习题详情和答案>>(1)中学化学实验中的中和热的测定所需的玻璃仪器除烧杯和温度计外还有 。?
(2)该实验常用0.50 mol·L-1HCl和0.55 mol·L-1?的NaOH溶液各50 mL进行反应。实验中,使NaOH溶液稍过量的主要原因是 。?
(3)若上述HCl、NaOH溶液的密度都近似为1 g·cm-3,若反应前后的温度分别为t1℃、?t2℃,中和后生成的溶液的比热容c =4.18 J/(g·℃),则该中和反应放出热量为 kJ(填表达式),其中和热ΔH? kJ·mol-1(填表达式)。?
Ⅱ.根据科学实验统计,香烟烟雾中有1 000多种化合物。其中至少有300种化合物在不同程度上有毒,如一氧化碳、尼古丁、醛类等。某化学课外活动小组设计实验检验香烟烟雾中存在一氧化碳、尼古丁、醛类等有毒物质。?

如上图,D试管的支管与抽气装置相连,从D试管的支管处抽气,可使A上燃着的香烟的烟雾依次通过A、B、C、D四个装置,且每个装置只能吸收一种物质(A处香烟可连续燃烧)。

(1)尼古丁的结构如上,在尼古丁结构式中六元环上的一氯取代物有 种。?
(2)若用B装置检验醛类物质,则试管B中盛装的试剂是 。?
(3)已知:在血液中存在下述平衡:?
血红蛋白—O2+CO![]() 血红蛋白—CO+O2?
血红蛋白—CO+O2?
(血红色) (鲜红色)?
若用D装置检验CO的存在,则可采用D试管中加入5 mL新鲜动物血,其实验现象为 。该气体对人体有害,当发生中毒时,可采取的两种措施是① ;② 。依据的原理是 。
查看习题详情和答案>> CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |
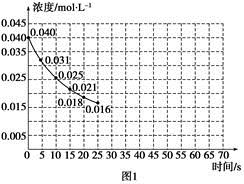
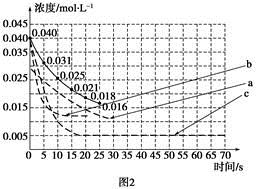
①若反应延续至70 s。请在图1中用实线画出25 s至70 s的反应进程曲线。
②某化学兴趣小组采用实验对比法分析改变实验条件对该反应进程的影响,每次只改变一个条件,并采集反应进程中CO2的浓度变化,在原有反应进程图像上绘制对应的曲线。实验数据如下表:
| 实验 编号 | CO2起始 浓度/mol·L-1 | 反应温 度/℃ | 反应压 强/kPa | 是否加入 催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |
但是该小组负责绘制图线的学生未将曲线(虚线)绘制完整(见图2),也忘记了注明每条曲线所对应改变的条件,请把每个实验编号与图2中对应曲线的字母进行连线。
实验编号 图2中字母
A a
B b
C c
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 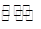 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |