网址:http://m.1010jiajiao.com/timu3_id_203145[举报]
如图所示的装置中发生反应2A2(g)+B2(g) 2C(g);△H=
-a kJ/mol(a >0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A, B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量 b kJ,B中C的浓度为w2 mol/L,放出热量 c kJ。请回答下列问题:
2C(g);△H=
-a kJ/mol(a >0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A, B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量 b kJ,B中C的浓度为w2 mol/L,放出热量 c kJ。请回答下列问题:
(1)此反应的平衡常数表达式为______________________;若将温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(2)比较大小:w1_____ w2(填>、=、<),a、b、c由大到小的关系 ______________________。
(3)若打开K,一段时间后重新达平衡,容器B的体积将______________________(填增大,减小或不变)。
(4)若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3 mol/L,则 w1,w3的关系______________________。
(5)能说明A中已达到平衡状态的是 (填序号,有一个或多个选项符合题意)。
a、v(C)=2v(B2)
b、容器内气体压强保持不变
c、容器中气体的平均相对分子质量不随时间而变化
d、容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
查看习题详情和答案>>
本题中有一个或两个选项符合题意.请选择.a、b两容器,a容积可随压强大小而变,b的容积固定.将适量的二氧化硫和氧气的混合物分为二等份,分别装入两容器中,恰好使两容器中气体的压强相等.在一定温度下发生反应,经过一段时间两容器中的反应均达平衡.此时b中二氧化硫的转化率为80%,则a中二氧化硫的转化率应为
- A.<80%
- B.>80%
- C.=80%
- D.无法判断
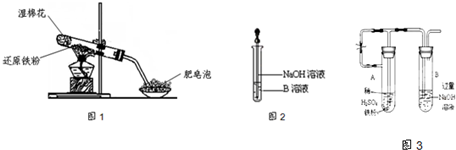
已知:①FeO+2H+=Fe2++H2O②Fe2O3+6H+=2Fe3++3H2O ③Fe3O4+8H+=Fe2++2Fe3++4H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为
| ||
| ||
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)
A.一定有Fe3O4,可能有Fe B.只有Fe(OH)3C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有FeE.只有Fe3O4
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按图2所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用图3所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应.获得不含O2的蒸馏水的方法是
一段时间后,关闭止水夹,在试管
(16分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧是将瓷坩埚置于 上(用以下所给仪器编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是( )(填字母编号,有两个选项符合题意。)
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解成铜 d.该条件下铜无法被氧化
(3)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比途径Ⅱ有明显的两个优点:
、
查看习题详情和答案>>
(17分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。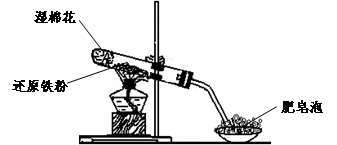
已知:①FeO + 2H+ = Fe2+ + H2O②Fe2O3 + 6H+ = 2Fe3+ +3 H2O ③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为 。
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) ,若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意) 。
| A.一定有Fe3O4,可能有Fe | B.只有Fe(OH)3 | C.一定有Fe3O4和Fe |
| D.一定有Fe(OH)3,可能有Fe E.只有Fe3O4 |
(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是______________。反应开始时,打开止水夹的目的是___________________________________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2
 查看习题详情和答案>>
查看习题详情和答案>>