摘要:电解饱和食盐水可以制得NaOH.其反应原理为 . NaOH的电离方程式是 .
网址:http://m.1010jiajiao.com/timu3_id_201425[举报]
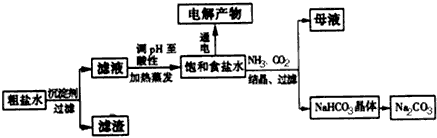
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许______(填离子符号,下同)通过,而不允许______和气体通过.电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH ②Na2CO3 ③BaCl2④盐酸,这四种试剂的添加顺序为______ (填序号).
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
①图中X、Y分别是______、______(填化学式),分析比较图示中氢氧化钠质量分数 a%与b%的大小______;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:______;
③这样设计的主要节(电)能之处在于(写出2处)______、______.
查看习题详情和答案>>
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许______(填离子符号,下同)通过,而不允许______和气体通过.电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH ②Na2CO3 ③BaCl2④盐酸,这四种试剂的添加顺序为______ (填序号).
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①图中X、Y分别是______、______(填化学式),分析比较图示中氢氧化钠质量分数 a%与b%的大小______;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:______;
③这样设计的主要节(电)能之处在于(写出2处)______、______.
查看习题详情和答案>>
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许______(填离子符号,下同)通过,而不允许______和气体通过.电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH②Na2CO3③BaCl2④盐酸,这四种试剂的添加顺序为______ (填序号).
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
①图中X、Y分别是______、______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小______;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:______;
③这样设计的主要节(电)能之处在于(写出2处)______、______.
查看习题详情和答案>>
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许______(填离子符号,下同)通过,而不允许______和气体通过.电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH②Na2CO3③BaCl2④盐酸,这四种试剂的添加顺序为______ (填序号).
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①图中X、Y分别是______、______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小______;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:______;
③这样设计的主要节(电)能之处在于(写出2处)______、______.
(2010?海南模拟)工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
①图中X、Y分别是
②分别写出燃料电池B中正极、负极上发生的电极反应正极:
③这样设计的主要节(电)能之处在于(写出2处)
查看习题详情和答案>>
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许
Na+
Na+
(填离子符号,下同)通过,而不允许Cl-、OH-
Cl-、OH-
和气体通过.电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH ②Na2CO3 ③BaCl2④盐酸,这四种试剂的添加顺序为③②①④或①③②④
③②①④或①③②④
(填序号).氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①图中X、Y分别是
Cl2
Cl2
、H2
H2
(填化学式),分析比较图示中氢氧化钠质量分数 a%与b%的大小a%小于b%
a%小于b%
;②分别写出燃料电池B中正极、负极上发生的电极反应正极:
O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
; 负极:H2-2e-+2OH-=2H2O
H2-2e-+2OH-=2H2O
;③这样设计的主要节(电)能之处在于(写出2处)
燃料电池可以补充电解池消耗的电能
燃料电池可以补充电解池消耗的电能
、提高产出碱液的浓度(降低能耗)
提高产出碱液的浓度(降低能耗)
.近年来,我国酸雨污染较为严重,防治酸雨成了迫在眉睫的问题.
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液.(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸.(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用.
①写出步骤(I)反应的化学方程式:
②写出步骤(III)反应的离子方程式:
(2)还有学者提出利用 Fe2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用.某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率.

①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号)

A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
②若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品.该技术的优点是
(4)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
Sx、CO+
Sx=COS、2COS+SO2=2CO2+
Sx.其中COS中“C”化合价为
查看习题详情和答案>>
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液.(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸.(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用.
①写出步骤(I)反应的化学方程式:
SO2+NaOH=NaHSO3
SO2+NaOH=NaHSO3
②写出步骤(III)反应的离子方程式:
HSO3-+H+═SO2+H2O
HSO3-+H+═SO2+H2O
(2)还有学者提出利用 Fe2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用.某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率.

①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号)
AB
AB
.
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
②若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量
实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品.该技术的优点是
变废为肥,充分利用资源,降低污染
变废为肥,充分利用资源,降低污染
.(4)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
| 1 |
| x |
| 1 |
| x |
| 3 |
| x |
+4
+4
.