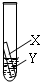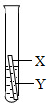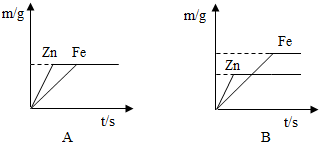摘要:9.在探究铁.铜.锌.银的金属活动性顺序时.某小组做了如下三个实验:(所用金属的形状与大小及稀盐酸的用量均相同) (1)实验①中的反应化学方程式为 . (2)一段时间后.根据实验②观察到现象.可得出结论是 . (3)乙同学认为上述三个实验不能够得出四种金属的活动性顺序. 还需要利用右图所示的实验装置.补充实验来实现探究目的. 乙同学实验用的金属X是 .溶液Y是 ,. 答案: (1) Fe +2HCl → FeCl2 + H2↑ (2)铜的活泼性大于银 (3)Fe .CuSO4 (北京市平谷区2010年初三第一次统一练习第28题)
网址:http://m.1010jiajiao.com/timu3_id_20142[举报]
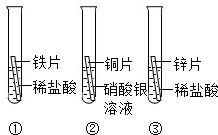
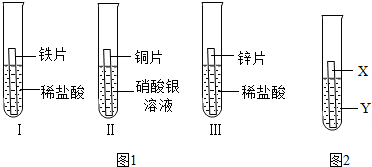
在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如图所示三个实验:(所用金属的形状与大小及稀盐酸的用量均相同)
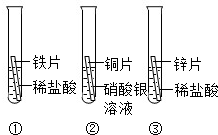
(1)实验①中的反应化学方程式为 .
(2)一段时间后,根据实验②观察到现象,可得出结论是 .
(3)乙同学认为上述三个实验不能够得出四种金属的活动性顺序,还需要利用如图所示的实验装置,补充实验来实现探究目的.
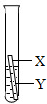
乙同学实验用的金属X是 ,溶液Y是 ;(其他合理答案也可)(要求写出化学式).
(4)丙同学用100g上述实验的盐酸分别跟足量的铁和锌反应,并绘制了生成氢气的质量(m/g)与时间(t/s)的关系图(如图所示).试回答:
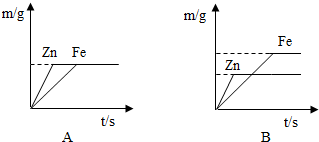
①判断A、B两图能表示丙同学所做实验结果是 图.
②若用100g盐酸与足量的铁反应能生成0.4g氢气.那么:
(Ⅰ)该盐酸溶液含HCl质量是 .
(Ⅱ)该盐酸中溶质的质量分数是 .
查看习题详情和答案>>

(1)实验①中的反应化学方程式为
(2)一段时间后,根据实验②观察到现象,可得出结论是
(3)乙同学认为上述三个实验不能够得出四种金属的活动性顺序,还需要利用如图所示的实验装置,补充实验来实现探究目的.

乙同学实验用的金属X是
(4)丙同学用100g上述实验的盐酸分别跟足量的铁和锌反应,并绘制了生成氢气的质量(m/g)与时间(t/s)的关系图(如图所示).试回答:

①判断A、B两图能表示丙同学所做实验结果是
②若用100g盐酸与足量的铁反应能生成0.4g氢气.那么:
(Ⅰ)该盐酸溶液含HCl质量是
(Ⅱ)该盐酸中溶质的质量分数是
 在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)①一段时间后,可观察到实验Ⅱ现象是
铜片表面有银白色固体析出,溶液由无色变为蓝色
铜片表面有银白色固体析出,溶液由无色变为蓝色
;反应的化学方程式是Cu+2AgNO3═2Ag+Cu(NO3)2
Cu+2AgNO3═2Ag+Cu(NO3)2
;②甲同学认为:通过实验Ⅰ和Ⅲ可比较出锌和铁金属活动性强弱.你认为他依据的实验现象是
锌与酸反应的程度要比铁的剧烈
锌与酸反应的程度要比铁的剧烈
.③乙和丙两位同学认为上述三个实验不能够得出四种金属活动性顺序,原因是
无法比较铁与铜的活动性
无法比较铁与铜的活动性
;并在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的.他们的实验:X是金属
Fe
Fe
,Y是CuSO4
CuSO4
溶液(写出化学式).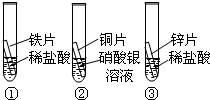 在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:
在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验: