网址:http://m.1010jiajiao.com/timu3_id_200439[举报]
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因
(2)NaHCO3溶液中各离子的浓度由大到小的关系是
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol?L-1 | 0.020 | 0.020 | 0 |
| 平衡浓度/mol?L-1 | 0.016 | 0.016 | 0.0080 |
(1)反应达到平衡时,A的转化率为
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为
 在容积为V L的密闭容器中发生2NO2?2NO+O2的反应.反应过程中NO2的物质的量随时间变化的状况如图所示.
在容积为V L的密闭容器中发生2NO2?2NO+O2的反应.反应过程中NO2的物质的量随时间变化的状况如图所示.(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是
A.有、无催化剂 B.压强不同 C.温度不同
(2)写出该反应的化学平衡常数K的表达式
| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
K800℃
(3)求在B条件下从反应开始至达到平衡,氧气的反应速率VO2=
| 0.025 |
| V |
| 0.025 |
| V |
(4)能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO)
B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变
D.气体的密度保持不变.
| A、Cl2、HBr、HCl、H2 | B、Cl2、HCl、HBr、H2 | C、Cl2、HBr、H2、HCl | D、Cl2、H2、HCl、HBr |
已知A和B两支试管所盛的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3—六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含的离子是_______________________。
(2)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是___ _______(填化学式)。
(3)若试管A和试管B中的溶液是由等物质的量的四种物质配成的溶液,将两试管中溶液混合后过滤,所得滤液中各种离子的物质的量之比为__ ______。
(12分)恒容容积为VL的密闭容器中发生2NO2 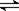 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是 。
A.有、无催化剂 B.温度不同 C.压强不同 D.体积不同
(2)写出该反应的化学平衡常数K的表达式: ,并比较K800℃ K850℃(填“>”、“<”或“=”)。
(3)求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)= 。
(4)不能说明该反应已达到平衡状态的是 。
A.v正(NO2)=v逆(NO) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(5)在如图所示的三个容积相同的三个容器①、②、③进行反应:2NO+O2  2NO2
2NO2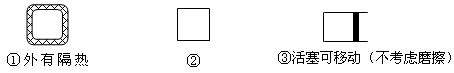
若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号) 。