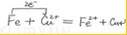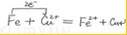摘要:25.某工厂的工业废水中含有大量的ZnSO4.较多的Cu2+和少量的Na+.为了减少污染并变废为宝.工厂计划从该废水中回收硫酸锌和金属铜.请根据如下流程图.回答下列问题.完成回收硫酸锌和金属铜的简单实验方案. (1)步骤①中加入物质的化学式 , (2)步骤②中加入物质的名称 . (3)步骤①.②的操作方法是 , (4)步骤③的操作方法是 .
网址:http://m.1010jiajiao.com/timu3_id_200383[举报]
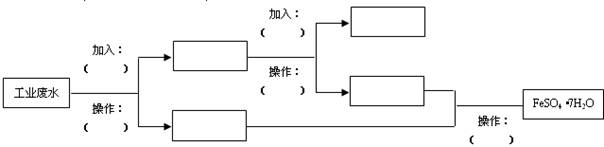
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案.
(1)A是
(2)操作Ⅱ是
查看习题详情和答案>>

(1)A是
Fe
Fe
,B是H2SO4
H2SO4
.(2)操作Ⅱ是
过滤
过滤
,操作Ⅲ是蒸发、冷却、结晶
蒸发、冷却、结晶
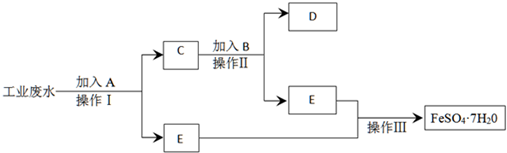
.某工厂的工业废水中含有Fe3+、Cu2+、SO42-等离子,为了减少污染并变废为宝,工厂计划从该废水中回收金属铜并得到硫酸亚铁.生产流程如下图所示(所加试剂均为过量):

请回答:
(1)试剂①应该是
(2)步骤①、②、③中共同的分离提纯方法是
(3)某同学为了验证长期放置的FeSO4?7H2O固体是否变质,取少量该固体于试管中,加入少量蒸馏水,再滴入几滴
查看习题详情和答案>>

请回答:
(1)试剂①应该是
铁粉
铁粉
,A中含有的物质是Fe和 Cu
Fe和 Cu
.步骤①中发生反应的离子方程式为2Fe3++Fe═3 Fe2+、Cu2++Fe═Fe2++Cu
2Fe3++Fe═3 Fe2+、Cu2++Fe═Fe2++Cu
.(2)步骤①、②、③中共同的分离提纯方法是
过滤
过滤
,步骤③中还需要的分离提纯方法是蒸发
蒸发
.(3)某同学为了验证长期放置的FeSO4?7H2O固体是否变质,取少量该固体于试管中,加入少量蒸馏水,再滴入几滴
KSCN
KSCN
溶液,若观察到溶液变红
溶液变红
,则证明该固体已经变质.某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案.
(1)试剂a为
(2)物质1为
(3)操作1为
(4)若操作1所涉及的反应为氧化还原反应,请用单线桥法标出反应中电子转移的方向和数目: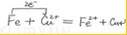
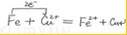 .
.

查看习题详情和答案>>
(1)试剂a为
Fe
Fe
,试剂b为H2SO4
H2SO4
.(2)物质1为
Cu、Fe
Cu、Fe
.(3)操作1为
过滤
过滤
,操作1所需的玻璃仪器为漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
.(4)若操作1所涉及的反应为氧化还原反应,请用单线桥法标出反应中电子转移的方向和数目: