摘要:17.已知NaCl.Na2SO4和Na3PO4三种溶液的物质的量浓度之比为6:3:2.三种溶液的体积比为3:2:1.则三种溶液中Na+离子个数之比为 A.1:2:3 B.3:2:1 C.9:3:1 D.1:3:9
网址:http://m.1010jiajiao.com/timu3_id_200076[举报]
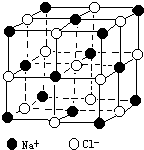 随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:
随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中.
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为V cm3.
(1)步骤①中仪器A最好使用
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管
(3)能否用水代替苯
(4)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如图),则用上述方法测得的阿佛加德常数NA的表达式为
已知NaCl(s)+H2SO4(浓)
NaHSO4+HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应.求:
(1)产生的HCl在标况时的体积为多少?
(2)将所得HCl气体溶于水中,配成500mL盐酸溶液,则盐酸的物质的量浓度为多少?
查看习题详情和答案>>
| ||
(1)产生的HCl在标况时的体积为多少?
(2)将所得HCl气体溶于水中,配成500mL盐酸溶液,则盐酸的物质的量浓度为多少?
 (2013?济宁二模)已知尿素的结构式为:
(2013?济宁二模)已知尿素的结构式为: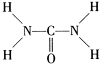 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.(1)基态Fe3+的核外电子排布式为
1s22s22p63s23p63d5
1s22s22p63s23p63d5
;C、N、O三种元素的第一电离能由大到小的顺序是N>O>C
N>O>C
.(2)尿素分子中N原子的杂化方式是
sp3
sp3
.(3)NH+4中H-N-H键角比NH3中H-N-H键角大,原因为
NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小
NH3中N原子含有1对孤对电子,NH+4中N原子没有孤对电子,NH+4中N-H键之间的排斥力较小
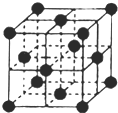
.(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示.
①1个CO2分子周围等距离且距离最近的CO2分子有
12
12
个.②NaCl晶胞也为面心立方结构,已知NaCl晶体密度为ρg?cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为
| 234 |
| ρNA |
| 234 |
| ρNA |
 已知NaCl的摩尔质量为58.5g?mol-1,其晶体密度为d g?cm-3,若右图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示( )
已知NaCl的摩尔质量为58.5g?mol-1,其晶体密度为d g?cm-3,若右图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示( )