网址:http://m.1010jiajiao.com/timu3_id_199105[举报]
(15分)【化学——选修2:化学与技术】
(一)硫酸厂常用煅烧黄铁矿(FeS2)来制取硫酸。
(1)煅烧黄铁矿的主要化学方程式为 。
(2)SO2和O2的反应为 2SO2(g)+O2(g) 2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
A.v正(SO2)=v正(SO3)
B.各组分的体积分数不再变化
C.反应体系的温度不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
(3)热交换器是实现冷热交换的装置,化学实验中也经常利用热交换来实现某种实验目的。试分析气、液热交换时通常使用的仪器是________________________。(写名称)
(4)硫酸工业所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是___________________。(填序号)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C. 氨水、酚酞试液 D.碘水、淀粉溶液
(二)实验室常用硫酸厂的烧渣(主要成分是Fe2O3及少量FeS、SiO2)来制备绿矾(FeSO4·7H2O)。
其中测定绿矾产品中FeSO4·7H2O含量的实验步骤为:
a.称取5.2 g产品,溶解,配成250 mL溶液
b.量取25.00 ml待测液于锥形瓶中
c.用硫酸酸化的0. 01 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积35.00 mL。
据此,请分析:
(1)滴定时反应的离子方程式为(完成并配平离子反应方程式)。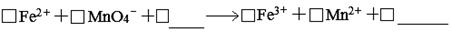
(2)滴定达到终点的标志是 。
(3)产品中FeSO4·7H2O的质量分数为 。
(一)硫酸厂常用煅烧黄铁矿(FeS2)来制取硫酸。
(1)煅烧黄铁矿的主要化学方程式为 。
(2)SO2和O2的反应为 2SO2(g)+O2(g)
 2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。A.v正(SO2)=v正(SO3)
B.各组分的体积分数不再变化
C.反应体系的温度不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
(3)热交换器是实现冷热交换的装置,化学实验中也经常利用热交换来实现某种实验目的。试分析气、液热交换时通常使用的仪器是________________________。(写名称)
(4)硫酸工业所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是___________________。(填序号)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C. 氨水、酚酞试液 D.碘水、淀粉溶液
(二)实验室常用硫酸厂的烧渣(主要成分是Fe2O3及少量FeS、SiO2)来制备绿矾(FeSO4·7H2O)。
其中测定绿矾产品中FeSO4·7H2O含量的实验步骤为:
a.称取5.2 g产品,溶解,配成250 mL溶液
b.量取25.00 ml待测液于锥形瓶中
c.用硫酸酸化的0. 01 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积35.00 mL。
据此,请分析:
(1)滴定时反应的离子方程式为(完成并配平离子反应方程式)。
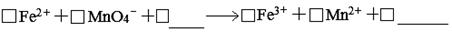
(2)滴定达到终点的标志是 。
(3)产品中FeSO4·7H2O的质量分数为 。
①将一定质量的碳酸钠置于小烧杯内,用少量水将其溶解
②待溶液冷至室温后,将其完全转移到容量瓶内,摇匀
③计算所需碳酸钠的质量,并用精密天平准确称取
④加水至容量瓶内,使凹液面最低点与容量瓶的刻度线相切,盖上塞子摇匀
⑤检查容量瓶是否渗漏
若量取20.00mL该碳酸钠溶液,应选用的量器是
(2)根据现有中学化学知识,判断下列有关实验叙述正确的是
A.检验红砖中氧化铁成分用到的试剂是盐酸和硫氰化钾溶液
B.用冰醋酸、蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
C.中和滴定时,酸式滴定管用蒸馏水清洗3次后,即加入标准盐酸溶液进行滴定
D.实验室用洁净的试管做银镜反应时不能将试管直接放酒精灯火焰上加热
E.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来.
(12分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是 ;
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
① 甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 ;
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
② 乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr +H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体在标准状况下密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
 (3)装置B中试剂的作用是
;
(3)装置B中试剂的作用是
;
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示);
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 ;[来源:]
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
查看习题详情和答案>>