摘要:1 mol/L×10×103 L x 所以.x=0.1 mol/L×10×103 L=1 000 mol 故该工厂产生的尾气中SO2气体的体积分数是 (1 000 mol×22.4 L/mol)/89.6×103 L×100%=25% 故该工厂产生的尾气中SO2气体的体积分数是25%. 答案:(1)①Na2SO3+SO2+H2O==2NaHSO3 ②2NaHSO3Na2SO3+SO2↑+H2O (2)25%
网址:http://m.1010jiajiao.com/timu3_id_199040[举报]
某探究小组通过比较酸性KMnO4溶液与H2C2O4溶液反应过程中,溶液紫色消失时间长短的方法,研究浓度、温度对反应速率的影响.
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01mol?L-1、0.1mol?L-1,H2C2O4溶液的浓度可选择0.1mol?L-1、0.2mol?L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)实验设计:请完成以下实验设计表.
(2)实验记录:实验中需要记录的数据是
查看习题详情和答案>>
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01mol?L-1、0.1mol?L-1,H2C2O4溶液的浓度可选择0.1mol?L-1、0.2mol?L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)实验设计:请完成以下实验设计表.
| 实验编号 | T/K | KMnO4浓度 /mol?L-1 |
H2C2O4浓度 /mol?L-1 |
实验目的 |
| ① | 298 | 0.01mol?L-1 | 0.1mol?L-1 | 为以下实验做对照 |
| ② | 323 323 |
0.01 mol?L-1 0.01 mol?L-1 |
0.1 mol?L-1 0.1 mol?L-1 |
探究温度对反应速率的影响 探究温度对反应速率的影响 |
| ③ | 298 298 |
0.01 mol?L-1 0.01 mol?L-1 |
0.2 mol?L-1 0.2 mol?L-1 |
探究浓度对反应速率的影响 |
各组实验中溶液褪色的时间
各组实验中溶液褪色的时间
.我国柴达木盆地拥有丰富的盐矿资源,液体矿床以钾矿为主,伴生着镁、溴等多种矿产.工业上取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),工业流程如图1:

请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有 .
(2)参照图2溶解度曲线,有人认为固体B是氯化钾,有人说是氯化镁,请说出你的观点和支撑你观点的理由: .
(3)同学甲模仿实验室中粗盐提纯的操作,对上述操作②后无色液体设计了除杂提纯实验方案,也可制得较纯净的氯化钾晶体.其方案流程如下:

有关资料:
(i)该方案中的无色溶液就是操作②后无色液体,混合液A的主要成分是 .(填化学式)有人认为用一种试剂 (填化学式)就可以起到混合液A的作用,你的观点是 .
(ii)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是 .
(ⅲ)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥ .(若离子浓度小于10-5mol?L-1可视作已被完全除尽).
(ⅳ)对溶液B加热并不断滴加1 mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.由溶液C得到固体C的操作名称是 .
(v)工业流程中也可以获得氯化镁的溶液,从中可以提取金属材料镁.方法是:加热蒸发氯化镁的溶液得到MgCl2?6H2O,在 中加热使其失去结晶水得到MgCl2,电解就可以得到金属镁.
查看习题详情和答案>>

请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有
(2)参照图2溶解度曲线,有人认为固体B是氯化钾,有人说是氯化镁,请说出你的观点和支撑你观点的理由:
(3)同学甲模仿实验室中粗盐提纯的操作,对上述操作②后无色液体设计了除杂提纯实验方案,也可制得较纯净的氯化钾晶体.其方案流程如下:

有关资料:
| 化学式 | Ca(OH)2 | CaSO4 | BaCO3 | BaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 1.0×10一4 | 7.1×10一5 | 8.1×10一9 | 1.08×10一10 | 3.5×10一5 | 1.6×10一11 |
(ii)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是
(ⅲ)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥
(ⅳ)对溶液B加热并不断滴加1 mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.由溶液C得到固体C的操作名称是
(v)工业流程中也可以获得氯化镁的溶液,从中可以提取金属材料镁.方法是:加热蒸发氯化镁的溶液得到MgCl2?6H2O,在
|
下列离子方程式正确的是 | |
| [ ] | |
A. |
氯化铵溶液呈酸性 NH |
B. |
氢硫酸电离 H2S |
C. |
向小苏打溶液中加入醋酸溶液 HCO |
D. |
在标准状况下,向10 mL 0.1 mol·L-1 FeBr2溶液中通入22.4 mL Cl2 2Fe2++2Br-+2Cl2 |
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
A.3∶2∶2 B.1∶2∶3?
C.1∶3∶3 D.3∶1∶1?
查看习题详情和答案>>(12分)实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。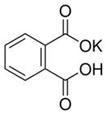
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
某学生进行了四次实验,实验数据如下表:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4080 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 | |
| 4 | 17.00 |
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.盛有邻苯二甲酸氢钾溶液的锥形瓶中有少量水
D.达到滴定终点时,俯视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
F.滴定到终点时,溶液颜色由无色变到了红色
(4)该同学所测得的NaOH溶液的物质的量浓度为________ mol·L-1(结果保留三位小数)。 查看习题详情和答案>>
 NH3+H+
NH3+H+ 2H++S2-
2H++S2- CO2+H2O
CO2+H2O 2Fe3++Br2+4Cl-
2Fe3++Br2+4Cl-