摘要:(五).化学反应与能量 1.略2.焓.H,产物总焓与反应物总焓之差.吸热反应.放热反应. 3.略 4略 5.氧化还原.化学能转变成电能的装置.电能转变成化学能的装置. 6.正极.负极.发生氧化反应的极是负极.发生还原反应的极是正极, 阴极.阳极.发生氧化反应的极是阳极.发生还原反应的极是阴极. 7.8.9.10.略 11.被腐蚀的金属成为原电池的负极.失电子变成金属阳离子. 12.在金属表面覆盖一层保护层.电化学保护.改变金属的内部结构. (六)化学反应速率和化学平衡 1.略 2.只含一个基元反应的反应.由几个基元反应组成的反应.基元反应构成的反应序列. 3.4.略 5.通过改变反应的历程来降低反应的活化能.从而提高化学反应速率,催化剂不能改变平衡常数.不能改变平衡转化率,催化剂具有选择性. 6. 7.略
网址:http://m.1010jiajiao.com/timu3_id_198918[举报]
(1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应与能量关系如下,请写出该反应的热化学方程式.
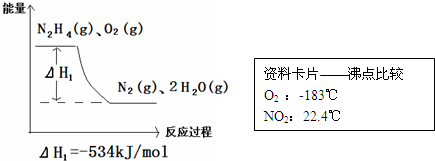
(2)已知N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol 请写出用NO2做氧化剂时的热化学方程式(产物为N2和H2O) ,通过上述数据可知,在O2、NO2两者间,火箭发射通常用 做氧化剂,原因是 .
查看习题详情和答案>>

(2)已知N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol 请写出用NO2做氧化剂时的热化学方程式(产物为N2和H2O)
化学反应与能量有比不可分的关系,回答下列问题.
Ⅰ:已知31g白磷变为31g红磷释放能量.试回答:
(1)上述变化属于
(2)31g白磷具有的能量_
(3)31g白磷完全燃烧释放的能量_
Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
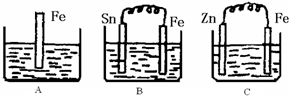
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A
(2)一段时间后,B中Sn极附近溶液的pH
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
Ⅲ:某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: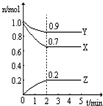
(1)该反应的化学方程式为
(2)反应开始至2min,以气体Z表示的平均反应速率为
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时
查看习题详情和答案>>
Ⅰ:已知31g白磷变为31g红磷释放能量.试回答:
(1)上述变化属于
化学
化学
(填“物理”或“化学”)变化.(2)31g白磷具有的能量_
>
>
(“>”或“<”)31g红磷具有的能量,常温常压下,红磷
红磷
更稳定.(3)31g白磷完全燃烧释放的能量_
>
>
(“>”或“<”)31g红磷完全燃烧释放的能量.Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸

(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
;BFe-2e-═Fe2+
Fe-2e-═Fe2+
;C2H++2e-═H2↑
2H++2e-═H2↑
.(2)一段时间后,B中Sn极附近溶液的pH
pH增大
pH增大
(填“增大”、“减小”、“不变”).(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
0.75
0.75
mol?L-1.此时,三个烧杯中液体质量由大到小的顺序为:C>A=B
C>A=B
(填写序号).(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
BAC
BAC
(填写序号).Ⅲ:某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)该反应的化学方程式为
3X+Y 2Z
2Z
 2Z
2Z3X+Y 2Z
2Z
. 2Z
2Z(2)反应开始至2min,以气体Z表示的平均反应速率为
0.05mol/(L.min)
0.05mol/(L.min)
.(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的
0.9
0.9
倍;②达平衡时,容器内混合气体的平均相对分子质量比起始投料时
增大
增大
(填“增大”“减小”或“相等”). 关于化学反应与能量的说法正确的是( )
关于化学反应与能量的说法正确的是( )