网址:http://m.1010jiajiao.com/timu3_id_198491[举报]
|
下列说法正确的是 | |
| [ ] | |
A. |
向饱和食盐水中加入少量的浓盐酸,看不到明显的现象 |
B. |
将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀是以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小 |
C. |
在0.01 mol/L NaCl溶液中加入少量的AgNO3溶液,有白色沉淀生成,接着向上述溶液中加入足量的浓氨水,白色沉淀不会溶解 |
D. |
CaCO3溶液的导电能力很弱,是因为CaCO3是弱电解质,存在如下电离平衡: CaCO3 |
|
下列说法中正确的是 | |
| [ ] | |
A. |
将10 g CaCO3粉末加水配成100 mL溶液,CaCO3物质的量浓度为l mol/L |
B. |
将100 mL 5 mol/L HCl溶液在蒸发皿中蒸发至50 mL溶液,HCL物质的量浓度变为10 mol/L |
C. |
将10 mL 0.1 mol/L NaCl溶液与90 mL水混合,所得溶液中NaCl物质的量浓度约为0.01 mol/L |
D. |
向100 mL饱和、澄清的石灰水中加入10 g CaO,搅拌、静置并恢复到原来的温度,石灰水中Ca(OH)2物质的量浓度变小了 |
海水中蕴藏着丰富的资源,海水综合利用的流程图如下.

(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是________.
②实验室用惰性电极电解100 mL 0.1 mol/L NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:________.
(2)分离出粗盐后的卤水中蕴含丰富的镁资源,经转化后可获得MgCl2粗产品.
①粗产品的溶液中含有Na+、Fe3+、Fe2+和Mn2+,需将Fe3+、Fe2+、Mn2+转化为沉淀除去;Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).若只加入题(1)中得到的一种产品即可达到上述除杂目的,则该产品的化学式为________,最终控制溶液的pH值为________.
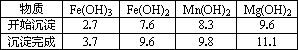
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:________.
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在.几种粒子之间有如下转化关系:
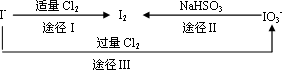
①如以途径Ⅰ制取I2,加的Cl2要适量,如过量就会发生途径Ⅲ的副反应,在该副反应产物中,IO3-与Cl-物质的量之比为1∶6,则氧化剂和还原剂物质的量之比为________.
②如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应的离子方程式是
________
|
下列有关物质的量浓度的相关说法中错误的是 | |
A. |
将25 g CuSO4·5H2O晶体加水配成100 mL溶液,该溶液的物质的量浓度为1 mol/L |
B. |
将100 mL 5 mol/L盐酸溶液在蒸发皿中蒸发至50 mL溶液,物质的量浓度变为10 mol/L |
C. |
将10 mL 0.1 mol/L NaCl溶液和90 mL水混合,所得溶液物质的量浓度约为0.01 mol/L |
D. |
实验室要用容量瓶配制0.2 mol/L的NaCl溶液950 mL,应称量NaCl固体11.1 g |