网址:http://m.1010jiajiao.com/timu3_id_198372[举报]
| |||||||||||||||
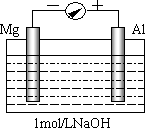
 图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性石墨电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,在X极附近观察到的现象是
| ||
| ||
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12L氯气时(标准状况),阴极增重3.2g.该金属的摩尔质量是
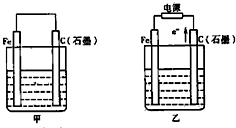 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为
②乙中总反应的离子方程式为
| ||
| ||
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为
(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为
②乙中Fe电极是
| ||
| ||
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为
(3)实验过程中,SO42-
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-═FeO42-+4H2O 和
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
III、分别放在图3装置(都盛有0.1mol?L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是
(8)利用图4装置,可以模拟铁的电化学防护.其中X为碳棒,为减缓铁的腐蚀,开关K应置于

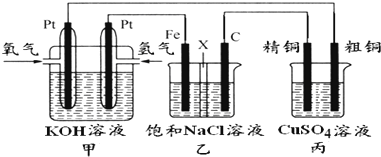
根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
(5)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为
| ||
| ||