网址:http://m.1010jiajiao.com/timu3_id_198315[举报]

(1)E(BD) 5晶体属于
(2)A元素和B元素组成的化合物分子之间
(3)基态E原子的电子排布式为
(4)B、C、D三种元素的电负性由大到小的顺序是
(5)C2和B2A2的分子中根据电子云重叠的方式不同,都包含的共价键类型有
(6)已知原子数和电子数相同的微粒叫等电子体,等电子体的结构相似.根据下表数据,说明BD分子比C2分子活泼的原因
| X-Y | X=Y | X≡Y | |
| BD的键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| C2的键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
X、Y、Z、W是原子序数依次增大的前四周期元素,已知:
①X元素原子的最外层电子数是次外层的2倍;
②Y元素原子的p轨道上有2个未成对电子;
③Z元素在同一短周期元素中的原子半径最大;
④W元素原子的最外层电子数与Z相同,其余各电子层均充满电子。
请回答下列问题:
(1)X、Y、Z三种元素的第一电离能从小到大的顺序是 (用元素符号表示,下同);
(2)W元素原子核外电子排布式是 ;
(3)Z元素与氢元素形成的化合物熔点比Y元素的氢化物熔点高,原因是 ;
(4)X的一种氢化物相对分子质量为42,分子中含有σ键和π键的个数比为8︰1,则该分子中X原子的杂化类型是 和 。
(5)Y的最简单氢化物可以和W2+形成配位键,而X的最简单氢化物则不行,其原因是 。
查看习题详情和答案>>
X、Y、Z、W是原子序数依次增大的前四周期元素,已知:
①X元素原子的最外层电子数是次外层的2倍;
②Y元素原子的p轨道上有2个未成对电子;
③Z元素在同一短周期元素中的原子半径最大;
④W元素原子的最外层电子数与Z相同,其余各电子层均充满电子。
请回答下列问题:
(1)X、Y、Z三种元素的第一电离能从小到大的顺序是 (用元素符号表示,下同);
(2)W元素原子核外电子排布式是 ;
(3)Z元素与氢元素形成的化合物熔点比Y元素的氢化物熔点高,原因是 ;
(4)X的一种氢化物相对分子质量为42,分子中含有σ键和π键的个数比为8︰1,则该分子中X原子的杂化类型是 和 。
(5)Y的最简单氢化物可以和W2+形成配位键,而X的最简单氢化物则不行,其原因是 。
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
|
元素代号 |
相关信息 |
|
X |
它的一种核素的原子核内没有中子 |
|
Y |
能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
|
Z |
基态原子的最外层电子排布式为nsnnpn+1 |
|
W |
与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
|
T |
主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
请推出具体元素,用具体元素回答下列问题:
(1)根据元素周期律可以设计出多种形式的周期表,下列是扇形元素周期表:
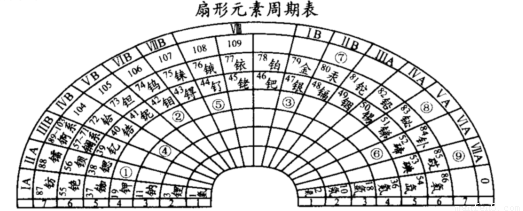
T元素在扇形元素周期表中的位置是 (填表中带圆圈的数字);上表中⑨号位置 的元素基态原子未成对电子数为 ;2012年6月25日,俄罗斯杜布纳核联合研究所再次成功合成117号元素,它将被列入元素周期表,“117”元素在扇形元素周期表中的位置是 (填表中带圆圈的数字)。
(2)质量数为2的X基态原子的电子排布式为 ,在这五种元素中电负性最大的是 。
(3)由上述五种元素中的某些元素形成的离子,该离子中每个原子最外层均有8个电子且 与Z3-具有相同质子数和电子数,则这种离子的结构式为 。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式: 。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ-
(aq)+X3W+(aq) ΔH=+45.6 KJ/mol
YZ-
(aq)+X3W+(aq) ΔH=+45.6 KJ/mol
X3W+(aq)+WX(aq)=2X2W(1) ΔH=-57.3 KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子厅程式表示): 。
查看习题详情和答案>>
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的最高价氧化物对应的水化物化学式为H2XO3 |
|
Y |
Y是地壳中含量最高的元素 |
|
Z |
Z的基态原子最外层电子排布式为3s23p1 |
|
W |
W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
(5)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下: 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
①反应物A的化学式为 ,属于 晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如下图所示, 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)

查看习题详情和答案>>