摘要:22.现有物质的量浓度为18.4mol/L的浓硫酸20.0mL.加入铜屑共热一段时间后.冷却.滤去多余的铜屑.将滤液加水到100.0mL.测得溶液中的物质的量浓度为
网址:http://m.1010jiajiao.com/timu3_id_198165[举报]
现有含H2SO4和K2SO4均为0.5mol·L-1 的混合液300mL,为配制成含H2SO4和K2SO4物质的量浓度分别为2mol·L-1和0. 2mol·L-1的混合液,需加入溶质的物质的量浓度为18.4mol·L-1的浓硫酸多少毫升,然后再加水稀释?
查看习题详情和答案>>
氨气极易溶于水,在0℃、1.01×105帕时,测得其饱和溶液的物质的量浓度为18.4mol/L,该溶液的密度为0.9g/cm3.
(1)氨水饱和溶液的质量分数是
(2)0℃、1.01×105帕时,1体积水中最多可溶解
查看习题详情和答案>>
(1)氨水饱和溶液的质量分数是
34.76%
34.76%
(2)0℃、1.01×105帕时,1体积水中最多可溶解
701.9
701.9
体积的氨气?化学探究小组的同学将过量锌粉与44mL浓硫酸在加热条件下充分反应,至不再产生气体时共收集到标准状况下11.2L的气体,其质量为19.6g.(若锌与浓硫酸在加热情况下发生的反应为:
Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O)
(1)试根据相关信息判断11.2L气体的成分,并计算气体中各成分的物质的量,填在以上表格内,每种气体只填一行(不一定填满).
(2)浓硫酸的物质的量浓度为
查看习题详情和答案>>
Zn+2H2SO4(浓)
| ||
| 气体的成分(化学式) | 气体的物质的量(mol) | |
| ① | ||
| ② | ||
| ③ |
(2)浓硫酸的物质的量浓度为
18.2mol/L
18.2mol/L
.如图所示是分离混合物时常用的仪器及实验室硫酸试剂标签,回答下列问题: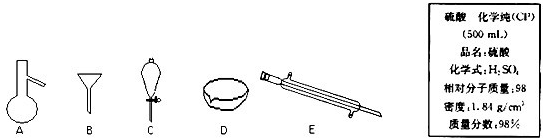
(1)写出仪器C、E的名称
(2)分离以下混合物应该主要选用使用什么仪器?(填字母符号)粗盐和泥沙:
(3)计算标签上硫酸的物质的量浓度为
查看习题详情和答案>>

(1)写出仪器C、E的名称
分液漏斗
分液漏斗
、冷凝管
冷凝管
.(2)分离以下混合物应该主要选用使用什么仪器?(填字母符号)粗盐和泥沙:
B
B
花生油和水:C
C
.(3)计算标签上硫酸的物质的量浓度为
18.4 mol?L-1
18.4 mol?L-1
. 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性.
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象.
③98%的浓H2SO4物质的量浓度为18.4mol/L,密度为1.84g?cm-3,根据以上信息回答:?
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓H2SO4 0.5mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释原因
H2SO4溶液的质量分数为23%<60%,其氧化性不强,所以无明显现象
H2SO4溶液的质量分数为23%<60%,其氧化性不强,所以无明显现象
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10mL与铜片反应.观察到右边试管中溶液褪色,这是因为
生成具有漂白性的二氧化硫
生成具有漂白性的二氧化硫
;若把品红试液换成硝酸酸化的硝酸钡溶液,产生的现象是由白色沉淀生成
由白色沉淀生成
;在左边试管中观察到的现象除了铜粉变黑色外,还有:①
液体呈浅蓝色
液体呈浅蓝色
,原因是溶液中含有Cu2+
溶液中含有Cu2+
②有白色固体在试管底部析出,原因是
98%浓H2SO4有吸水性,生成无水CuSO4
98%浓H2SO4有吸水性,生成无水CuSO4
;(3)丙同学等乙同学实验结束后,取左试管(内有没反应完的铜)倾出上层清液于试管中来检验剩余的硫酸,他可以选择下列哪些试剂
AD
AD
(填写编号).A.锌粉 B.银粉 C.氯化钡溶液 D.碳酸氢钠溶液.