网址:http://m.1010jiajiao.com/timu3_id_196747[举报]
常温下,将铁粉与硫粉混合,不发生反应。某课外活动活动小组将铁粉和硫粉按物质的量比1:1均匀混合,并置于水平放置且隔绝空气的玻璃管中,加热片刻,反应开始,然后撤去酒精灯,发现反应仍剧烈进行,并使生成的固体呈红
热状态。试回答:
(1)上述现象说明了
(2)将生成的黑色固体置于稀硫酸中,有气体放出,写出发生反应的离子方程式
(3)已知硫化氢是剧毒、有刺激性气味的气体,试说明实验室制取硫化氢时应采用的安全措施:
查看习题详情和答案>>(15分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: : ;
为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。①方案1中的B仪器名称是 。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4·5H2O的产率为 。
查看习题详情和答案>>
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: ;为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。
①方案1中的B仪器名称是 。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4·5H2O的产率为 。
查看习题详情和答案>>
(11分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)理论上硫酸和硝酸的物质的量之比最佳为: ︰ ;
(2)实际上,即使铜粉、硫酸及硝酸都比较纯净,制得的CuSO4·5H2O中还是有可能存在的杂质是 ,除去这种杂质的实验操作称为 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在___________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
①为了使铁元素全部沉淀,应调节pH至少为_________;
②甲物质可选用的是 ;
| A.CuCl2 | B.NaOH | C.Cu2(OH)2CO3 | D.CuO E.H2SO4 |
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50℃~60℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是 ;
⑤写出该反应的化学方程式为 。 查看习题详情和答案>>
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: ;为了吸收该反应中产生的尾气,请选择下列中合适的装置 。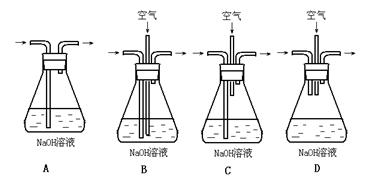
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。
①方案1中的B仪器名称是 。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E、Fe2(SO4)3 |
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4·5H2O的产率为 。 查看习题详情和答案>>