摘要:14.右图为氢氧燃料电池原理示意图.按照此图的提示.下列叙述不正确的是 A.a电极是负极 B.b电极发生氧化反应 C.氢氧燃料电池是一种具有应用前景的绿色电源 D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
网址:http://m.1010jiajiao.com/timu3_id_196579[举报]
 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:(1)图中通过负载的电子流动方向
向右
向右
(填“向左”或“向右)(2)写出氢氧燃料电池工作时电极反应方程式和总反应方程式正极:
2H2O+O2+4e-═4OH-
2H2O+O2+4e-═4OH-
负极:2H2+4OH--4e-═4H2O
2H2+4OH--4e-═4H2O
总反应:2H2+O2═2H2O
2H2+O2═2H2O
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和H2O反应生成H2和CO的化学方程式:
C3H8+3H2O
3CO+7H2
| ||
| 高温 |
C3H8+3H2O
3CO+7H2
| ||
| 高温 |
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为
CH4+10OH--8e-═CO32-+7H2O
CH4+10OH--8e-═CO32-+7H2O
,电池总离子反应方程式为CH4+2O2+2OH-═CO32-+3H2O
CH4+2O2+2OH-═CO32-+3H2O
.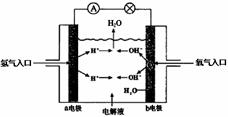 如图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式
如图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式(1)以硫酸为电解液:
负极:
2H2-4e-=4H+
2H2-4e-=4H+
正极:
O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
(2)以氢氧化钾为电解液:
负极:
2H2-4e-+4OH=4H2O
2H2-4e-+4OH=4H2O
正极:
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.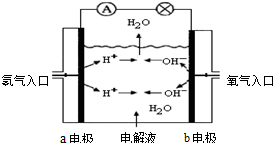 图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:
图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:(1)下列叙述不正确的是
B
B
A a电极是负极
B b电极的电极反应为:4OH--4e-=2H2O+O2↑
C 氢氧燃料电池是一种具有应用前景的绿色电源
D 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)若电解质溶液为KOH溶液,则电极反应式为:a极
2H2-4e-+4OH-=4H2O
2H2-4e-+4OH-=4H2O
b极O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
(3)若电解质溶液为稀H2SO4,则电极反应式为:a极
2H2-4e-=4H+
2H2-4e-=4H+
b极O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
.被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
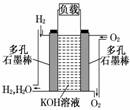
(1)图中通过负载的电子流动方向 (填“向左”或“向右)
(2)写出氢氧燃料电池工作时电极反应方程式和总反应方程式
正极:_____________________负极:
总反应:____________________
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和H2O反应生成H2和CO的化学方程式:
______ ____________________________
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,
负极反应式为
电池总离子反应方程式为
查看习题详情和答案>>
 如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )