摘要: 在实验中用MnO2与浓盐酸制取干燥纯净的Cl2.某学生设计的实验装置如图所示.B 中为浓H2SO4.C中为水 (1)指出此装置图的错误.并加以改正. ① ② ③ ④ ⑤ ⑥ A中反应的化学方程式是 的作用是 . 浓H2SO4的作用是 . (3)E中盛有的液体是 .其作用是 .反应的化学方程式为 . (4)如何判断Cl2已收集满:
网址:http://m.1010jiajiao.com/timu3_id_196449[举报]
实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:☆
Ⅰ.(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是
A.溶解后的溶液未冷至室温就转入容量瓶中;
B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时眼睛俯视刻度线;
D.定容时眼睛仰视刻度线;
Ⅱ.(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:

①写出甲中发生反应的离子方程式:
②乙中盛的试剂是
丙中盛的试剂是
(2)如果将过量二氧化锰与20mL该浓盐酸混合加热,充分反应后理论上可生成标况下的氯气的体积为
①
(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变
(4)若将制得的氯气制成饱和氯水,则实验室保存饱和氯水的方法是
查看习题详情和答案>>
Ⅰ.(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为
2.1mL
2.1mL
.(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
BCAFED
BCAFED
.A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是
AC
AC
.A.溶解后的溶液未冷至室温就转入容量瓶中;
B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时眼睛俯视刻度线;
D.定容时眼睛仰视刻度线;
Ⅱ.(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:

①写出甲中发生反应的离子方程式:
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
②乙中盛的试剂是
饱和NaCl溶液
饱和NaCl溶液
;作用是除去Cl2中混有的HCl气体
除去Cl2中混有的HCl气体
.丙中盛的试剂是
浓硫酸
浓硫酸
.(2)如果将过量二氧化锰与20mL该浓盐酸混合加热,充分反应后理论上可生成标况下的氯气的体积为
1344
1344
mL,而实际值明显少于理论值,其主要原因有:①
部分浓盐酸挥发了
部分浓盐酸挥发了
;②随着反应的进行浓盐酸变稀,稀盐酸不能被氧化成氯气
随着反应的进行浓盐酸变稀,稀盐酸不能被氧化成氯气
.(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变
棕黄色
棕黄色
色,其离子方程式是Cl2+2I-=2Cl-+I2
Cl2+2I-=2Cl-+I2
,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显紫红色
紫红色
色,这种操作叫做萃取
萃取
.(4)若将制得的氯气制成饱和氯水,则实验室保存饱和氯水的方法是
保存在细口棕色试剂瓶中,放置冷暗处
保存在细口棕色试剂瓶中,放置冷暗处
.
实验室用如图装置来制取干燥纯净的氯气,回答相关问题:

(1)写出上述制取氯气的化学方应方程式 .
(2)C装置的作用是 .
(3)F装置的作用是(用离子方程式表示) .
(4)若用8.7g MnO2与100mL 11mol/L的浓盐酸(足量)反应制取氯气,在标准状况下,生成氯气的体积为(不考虑氯气在溶液中的溶解) L.
(5)将上述反应后的溶液加水稀释到500mL,向从中取出的50mL溶液中加入足量AgNO3溶液,生成沉淀的物质的量为 mol.
查看习题详情和答案>>

(1)写出上述制取氯气的化学方应方程式
(2)C装置的作用是
(3)F装置的作用是(用离子方程式表示)
(4)若用8.7g MnO2与100mL 11mol/L的浓盐酸(足量)反应制取氯气,在标准状况下,生成氯气的体积为(不考虑氯气在溶液中的溶解)
(5)将上述反应后的溶液加水稀释到500mL,向从中取出的50mL溶液中加入足量AgNO3溶液,生成沉淀的物质的量为
实验室用下图所示的实验装置制取纯净干燥的无水CuCl2.

回答下列问题:
(1)仪器按上图连接好后,在添加药品前必须进行的实验操作是________.
(2)装置A中发生的化学反应方程式是________.8.7 g MnO2与足量浓盐酸反应生成标况下的氯气________L.
(3)装置B的广口瓶中盛有________(写名称),其作用是________;装置C中盛有________(写名称),其作用是________.
(4)写出D中发生的化学反应方程式________,E的作用是________.
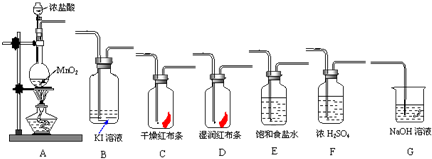
实验室里通常用MnO2与浓盐酸反应制取氯气.现用下列有关装置先制取干燥、纯净的氯气.后进行有关性质实验.试根据下列有关装置回答有关问题.

(1)上述装置中各仪器从左至右的连接顺序为A接
(2)E装置的作用是
(3)写出相关反应的离子方程式:A中
(4)在制取氯气的反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,如转移电子的物质的量是4mol,则被氧化的HCl的物质的量是
(5)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是
(6)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示)
查看习题详情和答案>>

(1)上述装置中各仪器从左至右的连接顺序为A接
E
E
接F
F
接C
C
接D
D
接B
B
接G.(2)E装置的作用是
除去氯化氢
除去氯化氢
,D中的现象为湿润的红色布条褪色
湿润的红色布条褪色
,B中的现象为溶液由无色变为褐色.
溶液由无色变为褐色.
(3)写出相关反应的离子方程式:A中
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
,B中
| ||
2I-+Cl2=I2+2Cl-
2I-+Cl2=I2+2Cl-
,G中Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(4)在制取氯气的反应:MnO2+4HCl(浓)
| ||
4
4
mol,有2
2
mol Cl2生成.(5)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是
4Cl2+8NaOH═6NaCl+NaClO3+NaClO+4H2O
4Cl2+8NaOH═6NaCl+NaClO3+NaClO+4H2O
.(6)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示)
Cl-+ClO-+2H+═Cl2↑+H2O
Cl-+ClO-+2H+═Cl2↑+H2O
.
 MnCl2+Cl2↑+2H2O中,如转移电子的物质的量是4mol,则被氧化的HCl的物质的量是______mol,有______ mol Cl2生成.
MnCl2+Cl2↑+2H2O中,如转移电子的物质的量是4mol,则被氧化的HCl的物质的量是______mol,有______ mol Cl2生成.