摘要: 下列反应不能制得NaOH的是 A.化合反应 B.分解反应 C.置换反应 D.复分解反应
网址:http://m.1010jiajiao.com/timu3_id_195887[举报]
下列说法正确的是( )
A.SiO2是酸性氧化物,不与任何酸、水反应,但能与NaOH溶液反应
B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液呈红色
C.CO2、SO2、NO2都能与水化合生成酸
D.Fe3O4与酸反应时,所得Fe元素的价态可能为+3或+2与+3价的混合物
查看习题详情和答案>>
A.SiO2是酸性氧化物,不与任何酸、水反应,但能与NaOH溶液反应
B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液呈红色
C.CO2、SO2、NO2都能与水化合生成酸
D.Fe3O4与酸反应时,所得Fe元素的价态可能为+3或+2与+3价的混合物
查看习题详情和答案>>
下列关于硅酸的说法正确的是
[ ]
A.硅酸可以由SiO2和水通过化合反应直接制得
B.由反应Na2SiO3+2HCl=2NaCl+ H2SiO3(胶体)制取硅酸是利用了可溶性酸制难溶性酸的性质
C.因为硅酸难溶于水,所以它不能与NaOH溶液反应
D.干燥剂“硅胶”的主要成分是硅酸
查看习题详情和答案>>
B.由反应Na2SiO3+2HCl=2NaCl+ H2SiO3(胶体)制取硅酸是利用了可溶性酸制难溶性酸的性质
C.因为硅酸难溶于水,所以它不能与NaOH溶液反应
D.干燥剂“硅胶”的主要成分是硅酸
运用化学反应原理研究氮、碳、硫等单质及其化合物的反应有重要意义。
(1)氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q(填 “>”、“<”或“=”) 184.4 kJ。
②已知

1mol N—H键断裂吸收的能量等于 kJ。
(2)硫酸的年产量可以用来衡量一个国家的化工生产能力。工业生产硫酸的流程中存在反应:2SO2(g)+O2(g) 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

①该反应的 0(填“>’或“<”)。
0(填“>’或“<”)。
②下列说法正确的是
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v正>v逆
c.B点、C点反应的平衡常数分别为K1、K2,则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3
(3)过度排放CO2会造成温室效应。
①最近科学家提出“绿色自由”构想能把空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出该电池负极反应式(电解液为KOH溶液) 。
②CO2也可用NaOH溶液吸收得到Na2CO3溶液,写出该反应的离子方程式 。
Na2CO3水溶液呈碱性,其原因是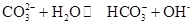 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
(1)氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q(填 “>”、“<”或“=”) 184.4 kJ。
②已知

1mol N—H键断裂吸收的能量等于 kJ。
(2)硫酸的年产量可以用来衡量一个国家的化工生产能力。工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)
 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①该反应的
 0(填“>’或“<”)。
0(填“>’或“<”)。②下列说法正确的是
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v正>v逆
c.B点、C点反应的平衡常数分别为K1、K2,则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3
(3)过度排放CO2会造成温室效应。
①最近科学家提出“绿色自由”构想能把空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出该电池负极反应式(电解液为KOH溶液) 。
②CO2也可用NaOH溶液吸收得到Na2CO3溶液,写出该反应的离子方程式 。
Na2CO3水溶液呈碱性,其原因是
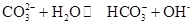 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。