摘要:(1)正 (2)2NaCl+2H2O2NaOH+H2↑+Cl2↑ (3)Zn-2e-Zn2+ Zn2++2e-==Zn ZnSO4溶液或ZnCl2溶液
网址:http://m.1010jiajiao.com/timu3_id_195785[举报]
按要求完成下列问题.
(1)写出铅蓄电池放电时的总反应和两个电极反应及反应类型
放电总反应:
负极:
正极:
(2)写出氯碱工业中电解饱和食盐水的总反应和两个电极反应及反应类型
电解总反应:
阳极:
阴极:
(3)氢氧燃料电池中用KOH做电解质溶液,H2是还原剂,O2是助燃剂,写出正、负两极的电极反应
负极:
正极:
查看习题详情和答案>>
(1)写出铅蓄电池放电时的总反应和两个电极反应及反应类型
放电总反应:
Pb+PbO2+2H2SO4═2PbSO4+2H2O
Pb+PbO2+2H2SO4═2PbSO4+2H2O
;负极:
Pb+SO42--2e-═PbSO4
Pb+SO42--2e-═PbSO4
,氧化
氧化
反应;正极:
PbO2+4H++SO42-+2e-═PbSO4+2H2O
PbO2+4H++SO42-+2e-═PbSO4+2H2O
,还原
还原
反应;(2)写出氯碱工业中电解饱和食盐水的总反应和两个电极反应及反应类型
电解总反应:
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
;
| ||
阳极:
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
,氧化
氧化
反应;阴极:
2H2O+2e-═H2 ↑+2OH-
2H2O+2e-═H2 ↑+2OH-
,还原
还原
反应;(3)氢氧燃料电池中用KOH做电解质溶液,H2是还原剂,O2是助燃剂,写出正、负两极的电极反应
负极:
2H2+4OH--4e-═4H2O
2H2+4OH--4e-═4H2O
;正极:
O2+4e-+2H2O═4OH-
O2+4e-+2H2O═4OH-
.图中A~I分别表示化学反应中的一种常见物质,工业上常用电解A的饱和溶液的方法制取B.其中E、F、J在通常情况下是气体单质,E为有色气体,J是空气中含量最多的气体,X是一种常见的金属单质.部分产物和反应条件略去.
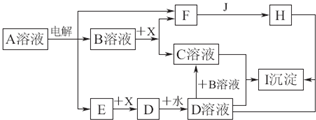
填写下列空白:
(1)写出电解A溶液的化学方程式:
(2)若将a mol D全部转化为C,则B的物质的量的取值范围为
(3)写出下列反应的离子方程式:
H+D→I:
B+X→C+F:
E与B溶液的反应:
查看习题详情和答案>>

填写下列空白:
(1)写出电解A溶液的化学方程式:
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
,电解过程中,向两极溶液中滴加酚酞试液,有一极溶液颜色变红,则该极为
| ||
阴
阴
(填“正”、“负”、“阴”或“阳”)极,该极的电极反应为2H++2e-═H2↑
2H++2e-═H2↑
.(2)若将a mol D全部转化为C,则B的物质的量的取值范围为
n(NaOH)≥4amol
n(NaOH)≥4amol
.(3)写出下列反应的离子方程式:
H+D→I:
3NH3?H2O+Al3+═Al(OH)3↓+3NH4+
3NH3?H2O+Al3+═Al(OH)3↓+3NH4+
;B+X→C+F:
2Al+2H2O+2OH-═2AlO2-+3H2↑
2Al+2H2O+2OH-═2AlO2-+3H2↑
;E与B溶液的反应:
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.已知由短周期元素组成的六种微粒A、B、C、D、E、F其所含原子核数目依次为2、3、4、5、1、1.其中A、B、E各含有18个电子,C、D、F各含有10个电子,A、B、C、D为常见化合物.请回答:
(1)D分子的空间构型为
(2)将B缓慢通入Cu(OH)2悬浊液中,浑浊液变为黑色,相应的化学方程式为
(3)A、C混合可生成一种新的化合物,该化合物中含有的化学键类型有
(4)①若E、F可按1:1组成离子化合物X,其水溶液呈中性.请写出电解X溶液的化学方程式:
②若Y溶液中所有离子间有以下关系:c(H+)+3c(F)=c(OH-)+c(E),则:Y溶液的pH
查看习题详情和答案>>
(1)D分子的空间构型为
正四面体
正四面体
.(2)将B缓慢通入Cu(OH)2悬浊液中,浑浊液变为黑色,相应的化学方程式为
H2S+Cu(OH)2=CuS+2H2O
H2S+Cu(OH)2=CuS+2H2O
.(3)A、C混合可生成一种新的化合物,该化合物中含有的化学键类型有
离子键、共价键
离子键、共价键
;室温下,将pH=a的C的稀溶液与pH=14-a的A稀溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+)
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
.(4)①若E、F可按1:1组成离子化合物X,其水溶液呈中性.请写出电解X溶液的化学方程式:
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
| ||
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
;电解时,阳极收集到的气体体积小于阴极,原因是
| ||
部分Cl2与NaOH溶液发生了反应而消耗
部分Cl2与NaOH溶液发生了反应而消耗
.②若Y溶液中所有离子间有以下关系:c(H+)+3c(F)=c(OH-)+c(E),则:Y溶液的pH
小于
小于
7(填“大于”、“小于”或“等于”),原因是(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.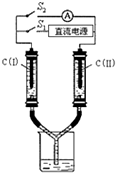 电化学在工业生产中有广泛应用.
电化学在工业生产中有广泛应用.(1)如图所示装置中,两玻璃管及烧杯中是滴有酚酞的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.
①电解NaCl饱和溶液的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
②接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成.则电极C(Ⅰ)是
阴
阴
(填“阳”或“阴”) 极;检验C(Ⅱ)电极反应所得气体产物的方法和现象是湿润的碘化钾淀粉试纸放在玻璃管口,试纸变蓝
湿润的碘化钾淀粉试纸放在玻璃管口,试纸变蓝
.③一段时间后(玻璃管中液面未脱离电极),断开S1,则C(Ⅰ)、C(Ⅱ)两玻璃管内气体的体积V(Ⅰ)、V(Ⅱ)的关系是:V(Ⅰ)
>
>
V(Ⅱ)(填“>”、“=”或“<”).断开S1接通S2,电流表的指针发生偏转,此时电极C(Ⅱ) 是正
正
(填“正”或“负”) 极;C(Ⅰ) 的电极反应是:H2-2e-+2OH-=2 H2O
H2-2e-+2OH-=2 H2O
.(2)若用此装置精炼粗铜,断开S2,接通S1,电解液选用CuSO4溶液,当电路中有0.04mol电子通过时,阴极增重
1.28
1.28
g.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.
接通电源,经过一段时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如图1.据此回答下列问题:

(1)M为电源的
(2)写出甲烧杯中反应的化学方程式
(3)有人设想用图2所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的
(4)有人设想用图3所示装置做直流电源,不仅可以完成电解也能将气体SO2 转化为重要化工原料.该设想中负极的电极反应式为
查看习题详情和答案>>
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
接通电源,经过一段时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如图1.据此回答下列问题:

(1)M为电源的
负
负
极(填“正”或“负”);甲、乙电解质分别为NaCl
NaCl
、AgNO3
AgNO3
(填化学式).(2)写出甲烧杯中反应的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
(3)有人设想用图2所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的
M
M
(填“M”或“N”)极.(4)有人设想用图3所示装置做直流电源,不仅可以完成电解也能将气体SO2 转化为重要化工原料.该设想中负极的电极反应式为
SO2+2H2O-2e-═4H++SO42-
SO2+2H2O-2e-═4H++SO42-
.