摘要:①增大 ②减小 ③增大 ④增大 ⑤增大 ⑥不变
网址:http://m.1010jiajiao.com/timu3_id_195784[举报]
增大压强,对已达到平衡的下列反应产生的影响是( )
3P(g)+Q(g)?2R(g)+2S(s)
查看习题详情和答案>>
3P(g)+Q(g)?2R(g)+2S(s)
| A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| C.正、逆反应速率都增大,平衡向正反应方向移动 |
| D.正、逆反应速率都没有变化,平衡不发生移动 |
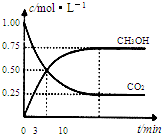 为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1.下列叙述中不正确的是( )
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1.下列叙述中不正确的是( )| A、0~3min内,v(CO2)正=v (CH3OH)正 | B、其他条件不变,若向平衡后的体系中充入1mol氦气,体系压强增大平衡将向正方向移动 | C、在T1℃时,若起始时向容器中充入2molCO2和6mol H2,测得平衡时容器内压强为P2,则 P2<2P1 | D、T2℃时,上述反应平衡常数为4.2,则T2>T1 |
(12分)
为减小和消除CO2对环境的影响,有科学家提出“绿色自由”构想。即先把空气吹人碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)写出分解池中反应的化学方程式 。
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式 。
当电子转移为 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)在体积为l L的密闭容器中,充人1mol CO2和3molH2在500°C下发生反应。有关物质的浓度随时问变化如下图所示。
①从反应开始到平衡,H2的平均反应速率v(H2)= 。
②若其他条件不变,只将温度提高到800°C,再次达平衡时,n(CH3OH)/n(CO2)比值 (填“增大”、“减小”或“不变”)。
查看习题详情和答案>>