摘要:利用氧化还原反应和离子反应可以制备很多物质.例如.实验室以Zn.CuO.H2SO4为原料.可按下列两种途径 I :Zn H2 Cu 途径 II :CuO CuSO4 Cu ⑴写出有关反应的化学方程式: 途径I: ,途径II: , ⑵若通过两种途径制得的等质量的Cu.下列说法正确的是 . ①消耗CuO的质量相等,②消耗Zn的质量相等,③消耗H2SO4的质量相等, ④生成ZnSO4的质量相等,⑤消耗H2SO4的质量不同,⑥途径I生成的ZnSO4较多.
网址:http://m.1010jiajiao.com/timu3_id_195579[举报]
含铁元素的物质有很多,它们对人体健康、生产生活都有重要作用,请完成以下填空:
(1)指出下列化合物中铁元素的化合价(O均为-2价):Fe(OH)2______ Fe2O3______ Na2FeO4______
(2)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色FeCl3溶液,取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,生成沉淀的离子方程式为______.另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至______色液体,停止加热,用______物理方法证明所得分散系的类别,写出制备该分散系的化学方程式______.
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌.工业制备Na2FeO4的化学方程式:
2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O(O均为-2价),请用双线桥表示该反应的电子转移方向和总数______.
(4)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现______(“氧化性”“还原性”).
查看习题详情和答案>>
含铁元素的物质有很多,它们对人体健康、生产生活都有重要作用,请完成以下填空:
(1)指出下列化合物中铁元素的化合价(O均为-2价):Fe(OH)2______ Fe2O3______ Na2FeO4______
(2)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色FeCl3溶液,取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,生成沉淀的离子方程式为______.另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至______色液体,停止加热,用______物理方法证明所得分散系的类别,写出制备该分散系的化学方程式______.
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌.工业制备Na2FeO4的化学方程式:
2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O(O均为-2价),请用双线桥表示该反应的电子转移方向和总数______.
(4)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现______(“氧化性”“还原性”).
查看习题详情和答案>>
(1)指出下列化合物中铁元素的化合价(O均为-2价):Fe(OH)2______ Fe2O3______ Na2FeO4______
(2)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色FeCl3溶液,取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,生成沉淀的离子方程式为______.另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至______色液体,停止加热,用______物理方法证明所得分散系的类别,写出制备该分散系的化学方程式______.
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌.工业制备Na2FeO4的化学方程式:
2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O(O均为-2价),请用双线桥表示该反应的电子转移方向和总数______.
(4)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现______(“氧化性”“还原性”).
含铁元素的物质有很多,它们对人体健康、生产生活都有重要作用,请完成以下填空:
(1)指出下列化合物中铁元素的化合价(O均为-2价):Fe(OH)2______ Fe2O3______ Na2FeO4______
(2)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色FeCl3溶液,取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,生成沉淀的离子方程式为______.另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至______色液体,停止加热,用______物理方法证明所得分散系的类别,写出制备该分散系的化学方程式______.
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌.工业制备Na2FeO4的化学方程式:
2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O(O均为-2价),请用双线桥表示该反应的电子转移方向和总数______.
(4)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现______(“氧化性”“还原性”).
查看习题详情和答案>>
(1)指出下列化合物中铁元素的化合价(O均为-2价):Fe(OH)2______ Fe2O3______ Na2FeO4______
(2)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色FeCl3溶液,取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,生成沉淀的离子方程式为______.另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至______色液体,停止加热,用______物理方法证明所得分散系的类别,写出制备该分散系的化学方程式______.
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌.工业制备Na2FeO4的化学方程式:
2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O(O均为-2价),请用双线桥表示该反应的电子转移方向和总数______.
(4)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现______(“氧化性”“还原性”).
查看习题详情和答案>>
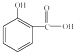 (1)食品和药品关系人的生存和健康.
(1)食品和药品关系人的生存和健康.①市场上销售的食盐品种很多.下列食盐中,所添加的元素不属于人体必需微量元素的是
A
A
(填字母).A.加钙盐 B.加碘盐 C.加锌盐
②碳酸镁可治疗胃酸过多的原理是
MgCO3+2H+=Mg2++CO2↑+H2O
MgCO3+2H+=Mg2++CO2↑+H2O
(用离子方程表示).③阿司匹林具有
解热镇痛
解热镇痛
作用.长期大量服用阿司匹林,其水解产物水杨酸可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:

(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活.
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其各成分金属的熔点
低
低
(选填“高”或“低”).②炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.铁锅的腐蚀主要是由
电化学腐蚀
电化学腐蚀
(填“化学腐蚀”或“电化学腐蚀”)造成的,铁锅锈蚀的负极电极反应式为Fe-2e-═Fe2+
Fe-2e-═Fe2+
.③玻璃是一种常用的硅酸盐材料.制备普通玻璃的原料有CaCO3、
Na2CO3
Na2CO3
(填化学式)和SiO2.(3)防治环境污染,改善生态环境已成为全球的共识.
①pH<5.6的雨水称为酸雨,主要是由人为排放的硫氧化物和
氮氧化物
氮氧化物
等酸性气体转化而成的.向煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO2.发生反应的化学方程式为2CaCO3+O2+2SO2
2CaSO4+2CO2
| ||
2CaCO3+O2+2SO2
2CaSO4+2CO2
.
| ||
②城市餐饮业会产生大量污染环境的“地沟油”.综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取甘油和
高级脂肪酸
高级脂肪酸
.生活中会产生大量废弃塑料,将废弃塑料进行裂解
裂解
处理,可以获得乙烯、丙烯等化工原料.③含铬元素的废水必须治理达标.某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3.该方案运用了污水处理方法中的氧化还原法和
沉淀法
沉淀法
.指导老师指出该方案处理后的废水中因含有大量NH4+
NH4+
(填离子符号),能导致水体富营养化.二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.

(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=
(2)汽车尾气中的主要污染物有CO、NOx、碳氢化合物等,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
生成无毒物质,减少汽车尾气污染.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图1所示,则
①前15s内的平均反应速率v (N2)=
②该反应平衡常数K=
③若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将
a 加入催化剂 b 降低温度 c 缩小容器体积 d 增加CO2的量
④该可逆反应△S
(3)CO分析仪以燃料电池为工作原理,其装置如图2所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是
A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现对SO2的处理目的.其中Fe3+的最外层电子排布式为
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图3所示,N2O5在电解池的
查看习题详情和答案>>

(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=
-867 kJ/mol
-867 kJ/mol
;(2)汽车尾气中的主要污染物有CO、NOx、碳氢化合物等,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
生成无毒物质,减少汽车尾气污染.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图1所示,则
①前15s内的平均反应速率v (N2)=
0.013 mol/(L?s)
0.013 mol/(L?s)
(小数点保留3位);②该反应平衡常数K=
0.035
0.035
(小数点保留3位);③若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将
不移动
不移动
移动(填“向左”、“向右”或“不”);20min时,若改变反应条件,导致N2浓度发生如图1所示的变化,则改变的条件可能是b
b
(填序号);a 加入催化剂 b 降低温度 c 缩小容器体积 d 增加CO2的量
④该可逆反应△S
<
<
0(填“>”、“<”或“=”),在低温
低温
(填“高温”、“低温”或“任何温度”)下能自发进行.(3)CO分析仪以燃料电池为工作原理,其装置如图2所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是
B
B
A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现对SO2的处理目的.其中Fe3+的最外层电子排布式为
3s23p63d5
3s23p63d5
;SO2的VSEPR模型名称为平面三角形
平面三角形
;与SO2互为等电子体的离子有NO2-
NO2-
.(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图3所示,N2O5在电解池的
阳极
阳极
(填“阳极”或“阴极”)区生成,其电极反应式为N2O4-2e-+2HNO3=2N2O5+2H+
N2O4-2e-+2HNO3=2N2O5+2H+
.