摘要:1.下列反应属于氧化还原反应的是( ) A.活性炭使红墨水褪色 B.NaOH露置在空气中质量增重 C.实验室制氢气 D.浓硫酸露置在空气中.质量增重
网址:http://m.1010jiajiao.com/timu3_id_195506[举报]
A.《化学与生活》
(1)南京“青奥会”已进入倒计时,体育场馆和城市交通建设日臻完善.
①体育场馆建设需大量建筑材料.下列材料不属于硅酸盐材料的是 (填字母).
a.石灰石 b.水泥 c.玻璃
②轨道交通建设需大量金属材料.下列金属材料最易发生腐蚀的是 (填字母).
a.铝合金 b.钢铁 c.纯铜
③“塑胶”跑道是由聚氨酯橡胶等材料建成.聚氨酯橡胶属于 (填字母).
a.金属材料 b.无机非金属材料 c.有机高分子材料
(2)“青奥会”期间,要保障运动员的营养与健康.
①及时补充体能是运动员取得优秀成绩的基本保证.六大基本营养素中能在人体内氧化供能的有糖类、 和 .
②水果和蔬菜富含VC.已知VC的结构为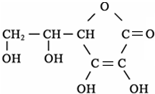 ,其分子式为
,其分子式为
;在氯化铁溶液中加入VC溶液后,溶液由黄色转变为浅绿色,说明VC具有较强的 性.
③服用违禁药物不仅妨碍体育竞技的公平、公正,也有害运动员的身心健康.在阿斯匹林、青霉素、麻黄素、小苏打等常用药物中,参赛选手不可服用的是 .
(3)“绿水蓝天”工程为运动员提供优良环境,向世界展示古都南京的美好形象.
①PM2.5指悬浮于大气中的直径≤2.5μm(微米)的颗粒物,大量PM2.5会造成灰霾天气,危害人体健康.燃煤气化有助于控制PM2.5的含量,写出焦炭与水蒸气反应的化学方程式 .
②汽车尾气中含有污染大气的NO和CO.给汽车排气管加装“催化转化器”,可使CO和NO反应生成无毒无污染的气体,反应的化学方程式为 .装有“催化转化器”的汽车必须使用无铅汽油,其原因是 .
③含铬元素的废水必须治理达标.某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3.该方案运用了污水处理方法中的氧化还原法和 .指导老师指出该方案处理后的废水中因含有大量 (填离子符号),能导致水体富营养化.
查看习题详情和答案>>
(1)南京“青奥会”已进入倒计时,体育场馆和城市交通建设日臻完善.
①体育场馆建设需大量建筑材料.下列材料不属于硅酸盐材料的是
a.石灰石 b.水泥 c.玻璃
②轨道交通建设需大量金属材料.下列金属材料最易发生腐蚀的是
a.铝合金 b.钢铁 c.纯铜
③“塑胶”跑道是由聚氨酯橡胶等材料建成.聚氨酯橡胶属于
a.金属材料 b.无机非金属材料 c.有机高分子材料
(2)“青奥会”期间,要保障运动员的营养与健康.
①及时补充体能是运动员取得优秀成绩的基本保证.六大基本营养素中能在人体内氧化供能的有糖类、
②水果和蔬菜富含VC.已知VC的结构为
 ,其分子式为
,其分子式为③服用违禁药物不仅妨碍体育竞技的公平、公正,也有害运动员的身心健康.在阿斯匹林、青霉素、麻黄素、小苏打等常用药物中,参赛选手不可服用的是
(3)“绿水蓝天”工程为运动员提供优良环境,向世界展示古都南京的美好形象.
①PM2.5指悬浮于大气中的直径≤2.5μm(微米)的颗粒物,大量PM2.5会造成灰霾天气,危害人体健康.燃煤气化有助于控制PM2.5的含量,写出焦炭与水蒸气反应的化学方程式
②汽车尾气中含有污染大气的NO和CO.给汽车排气管加装“催化转化器”,可使CO和NO反应生成无毒无污染的气体,反应的化学方程式为
③含铬元素的废水必须治理达标.某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3.该方案运用了污水处理方法中的氧化还原法和
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)  2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的最佳途径是使用高效催化剂 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的常用方法是升高温度 |
 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
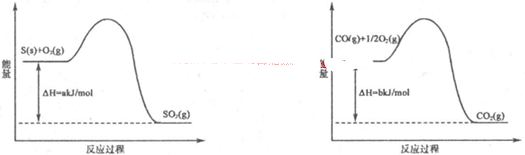
则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
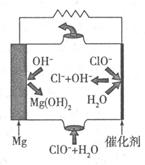
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。
 查看习题详情和答案>>
查看习题详情和答案>>