网址:http://m.1010jiajiao.com/timu3_id_195142[举报]
利用化学反应原理研究生产、生活中的实际问题具有十分重要的意义:
(Ⅰ)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_____92 kJ(填“大于”“等于”或“小于”),原因是_______;若加入催化剂,ΔH (填“变大”“变小”或“不变”)。
(2)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为______kJ。
(3)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4完全反应的热化学方程式为 。
(Ⅱ)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。
(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)若铅蓄电池工作时(放电),其E所在电极的电极反应式为: ,充电时该极与外加电源的 极相连。
(3)若用该电池电解Cu(NO3)2溶液,其电解方程式为
若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是 ;要想CuSO4溶液恢复原样,需加入的物质是 ,质量为
查看习题详情和答案>>
利用化学反应原理研究生产、生活中的实际问题具有十分重要的意义:
(Ⅰ)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_____92 kJ(填“大于”“等于”或“小于”),原因是_______;若加入催化剂,ΔH (填“变大”“变小”或“不变”)。
(2)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为______kJ。
(3)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4完全反应的热化学方程式为 。
(Ⅱ)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。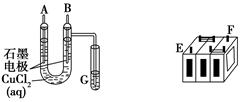
(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)若铅蓄电池工作时(放电),其E所在电极的电极反应式为: ,充电时该极与外加电源的 极相连。
(3)若用该电池电解Cu(NO3)2 溶液,其电解方程式为
若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是 ;要想CuSO4溶液恢复原样,需加入的物质是 ,质量为
(Ⅰ)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_____92 kJ(填“大于”“等于”或“小于”),原因是_______;若加入催化剂,ΔH (填“变大”“变小”或“不变”)。
(2)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为______kJ。
(3)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4完全反应的热化学方程式为 。
(Ⅱ)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。

(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)若铅蓄电池工作时(放电),其E所在电极的电极反应式为: ,充电时该极与外加电源的 极相连。
(3)若用该电池电解Cu(NO3)2 溶液,其电解方程式为
若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是 ;要想CuSO4溶液恢复原样,需加入的物质是 ,质量为
(1) 在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:


①第一步反应是 _________ 反应(选题“放热”或“吸热”),判断依据是
________________________________________
②1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是
________________________
(2) 用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
①滴定管在使用之前需要先___________________,再洗涤和润洗
②判断滴定终点的现象是
③根据以上数据可以计算出盐酸的物质的量浓度为 _______ mol·L-1(小数点后保留两位有效数字)。
④以下操作可能造成测定结果偏高的是 (填写序号)。
A.滴定前,碱式滴定管尖嘴有气泡,滴定后消失
B.滴定前读数正确,达到滴定终点后,俯视读数
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗酸式滴定管
(3) 由pH=3的HA(弱酸)与pH=11的NaOH溶液等体积混合,所得溶液中离子浓度大小的顺序为______________________________________
查看习题详情和答案>>(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数的表达式K = ,由上表数据可得,该反应为 反应。(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01 mol·L-1、c(H2O)=0.03mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率 (填"大"、"小"或"不能确定")
③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
①平衡时CH3OH的体积分数w为 。
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
| 容器 | 实验1 | 实验2 | 实验3 |
| 反应物投入量(始态) | 1mol CO2、3mol H2 | 1mol CH3OH、1mol H2O | 2mol CH3OH、2mol H2O |
| CH3OH的平衡浓度/mol·L-1 | C1 | C2 | C3 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ |
| 体系压强/Pa | P1 | P2 | P3 |
| 反应物转化率 | a1 | a2 | a3 |
A.2 C1>C3 B.x+y=49.0 C.2P2<P3
D.(a1+a3)<1 E.2P1>P3 F.a1= a2
③在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。
CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。
查看习题详情和答案>>