网址:http://m.1010jiajiao.com/timu3_id_194319[举报]
实验室常用饱和NaNO2和NH4Cl溶液反应制取纯净的氮气。反应式为:
NaNO2 + NH4Cl ="=" NaCl + N2↑+2H2O↑,该反应过程中放热。实验如下图,试回答: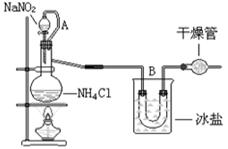
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是:________
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.NaNO2饱和溶液容易滴下
(2)B部分的作用是_________
a.冷凝 b.冷却氮气 c.缓冲氮气流
(3)加热前必须进行一个操作步骤是: ;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是: 。
(4)收集N2最适宜的方法是________
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中
实验室常用饱和NaNO2和NH4Cl溶液反应制取纯净的氮气。反应式为:
NaNO2 + NH4Cl == NaCl + N2↑+2H2O↑,该反应过程中放热。实验如下图,试回答:

(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是:________
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.NaNO2饱和溶液容易滴下
(2)B部分的作用是_________
a. 冷凝 b. 冷却氮气 c.缓冲氮气流
(3)加热前必须进行一个操作步骤是: ;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是: 。
(4)收集N2最适宜的方法是________
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中
查看习题详情和答案>>
Ⅰ.某学生想自己设计实验方案,以证明样品中确实没有FeO.除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液和双氧水.你认为要完成该实验所选择的试剂是_________,请你描述实验操作时的步骤、实验现象和结论:_____________________。
Ⅱ.测定混合物中Fe2O3的含量实验室可用多种方法测出上述样品中Fe2O3的质量分数.现有学生准备用题图中各装置按一定顺序连接成一套完整的组合装置来进行实验以测定Fe2O3的质量分数.

(1)装置的连接顺序是_________(填字母,每个装置只能用一次)
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还有一个重要作用是_________________
(3)下列各项措施中,能提高测定准确度的是__________(填标号)
a.在加入盐酸之前,应该排尽装置内的CO2气体
b.快速加入盐酸
c.在B中装入浓硫酸
d.在B中装入NaOH溶液
e.D之后增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验室准确称取26.0g固体样品装入D中,充分反应后,测得A中沉淀质量为19.7g,则样品中Fe2O3的质量分数为__________
(5)在进行实验方案评价时,有学生认为不必测定A中的沉淀质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe2O3的质量分数将______(填“偏高”、“偏低”、“不变”)
NaNO2 + NH4Cl ="=" NaCl + N2↑+2H2O↑,该反应过程中放热。实验如下图,试回答:

(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是:________
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.NaNO2饱和溶液容易滴下
(2)B部分的作用是_________
a.冷凝 b.冷却氮气 c.缓冲氮气流
(3)加热前必须进行一个操作步骤是: ;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是: 。
(4)收集N2最适宜的方法是________
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中
在实验室测定碳酸钠与碳酸氢钠的混合物中,碳酸钠的质量分数[用符号w(Na2CO3)表示],称取此混合物5.lg,溶于水中,配成250mL溶液。
a.(10分)方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是___________? (填编号)。
A.CaCl2?????? B.MgSO4????? C. .NaCI????? D.Ba(OH)2
(2)简述证明HCO3-、CO32-已完全沉淀的实验操作_________________________。
(3)过滤,提取沉淀,则过滤操作所需要的玻璃仪器有________________________。
(4)洗涤沉淀,简述洗涤沉淀的操作_____________________________。
(5)干燥充分,称取沉淀的质量为9.8g,由此计算w(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)________________(填偏大或偏小、无影响)。
b.方案二:滴定法测w(Na2CO3)量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸进行滴定到终点。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。????? [已知饱和的碳酸溶液PH为3.9]
(1)量取25.00 mL配制好的溶液,应选择_______________仪器来完成。
(2)判断滴定终点的依据是_____________________,此过程中反应的离子方程式为__________________________________________________。
(3)此法测得w(Na2CO3)=________%(保留两位小数)
查看习题详情和答案>>