网址:http://m.1010jiajiao.com/timu3_id_193759[举报]
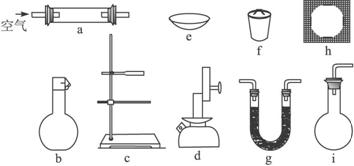
U形管中所装药品为①碱石灰(NaOH和CaO的固体混合物);②无水CaCl2
(1)为确定某固体有机物的最简式(实验式),上述仪器中需要的种类有_____________种,它们是_____________(填仪器编号,下同),其中使用最多的是_____________,为完成实验测定还缺少的一种重要仪器名称是__________________________。
(2)当g中盛碱石灰时装置的作用是_____________;盛碱石灰的装置至少需要使用_______次;盛无水氯化钙的装置至少需要使用_______次。
(3)确定固体有机物是烃还是其含氧衍生物的依据是_____________。
(4)为确定其分子式还需知道下述中的_____________(填字母)。
A.熔、沸点 B.可换算成标准状况下蒸气的密度
C.固体有机物的体积 D.重要的化学性质
查看习题详情和答案>>实验室采用燃烧有机物的方法使之生成CO2和H2O,通过测出它们的质量,以求得有机物中碳和氢的百分含量。现有某固态有机物(烃或烃的含氧衍生物),设想在加热情况下鼓入足量空气使其完全燃烧,以确定其化学式。今有下图所示一系列仪器:
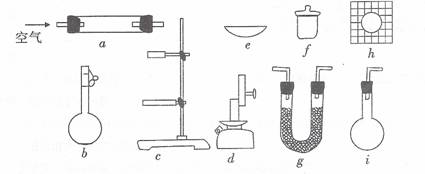
U形管中所装药品为①碱石灰(NaOH和CaO的固体混合物);②无水CaCl2
(1)为确定某固体有机物的最简式(实验式),上述仪器中需要的种类有 种,它们是 (填仪器编号,下同),其中使用最多的是 ,为完成实验测定还缺少的一种重要仪器名称是 。
(2)当g中盛碱石灰时装置的作用是 ;盛碱石灰的装置至少需要使用 次;盛无水氯化钙的装置至少需要使用
次。
(3)确定固体有机物是短还是其含氧衍生物的依据是
。
(4)为确定其分子式还需知道下述中的 (填字母)。
A.熔、沸点 B.可换算成的标准状况下蒸气的密度
C.固体有机物的体积 D.重要的化学性质
查看习题详情和答案>>查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成.
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水成分搅拌、过滤.
(1)往滤渣中加入过量NaOH溶液,过滤.氢氧化铝与NaOH溶液反应的离子方程式是
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察到的现象是
Ⅱ.牙膏样品中碳酸钙的定量测定
利用如下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有:
(4)C中反应生成BaCO3的化学方程式是
(5)下列各项措施中,不能提高测定准确度的是
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是