网址:http://m.1010jiajiao.com/timu3_id_193743[举报]
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.请回答下列问题(填空时用实际符号):
(1)C的元素符号是
(2)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为


(3)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示,已知断裂1molC-C吸收167kJ热量,生成1molC=C放出942kJ热量.根据以上信息和数据,下列说法正确的是
①C4属于一种新型的化合物
②C4沸点比P4(白磷)低
③lmol C4气体转变为C2吸收882kJ热量
④C4与C2互为同素异形体
⑤C4稳定性比P4(白磷)差
⑥C4属于原子晶体
⑦C4和P4 (白磷)的晶体都属于分子晶体
⑧C4与C2互为同分异构体
(4)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为


(5)为了除去化合物乙(A2ED4)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:
(6)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似.对此以下说法正确的是
a.E2F2的结构式为:F-E-E-F
b.E2F2为含有极性键 和非极性键的非极性分子
c.E2Br2与E2F2结构相似,熔沸点:E2Br2>E2F2
d.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+3E↓+4HF
(7)举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ② |
|
|
|
|
|
|
|
|
|
|
| ③ | ④ | ⑤ | ⑥ |
|
|
| ⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
| ⑧ |
|
|
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④ 元素⑤(选填“>”、“=”、“<”)。
b.与元素④所形成的单质互为等电子体的分子、离子的化学式 、 (各写一种)。
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________________
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质。则其负极反应式为_____________________________。
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子。0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为_________________________
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。 已知该原子的半径为d pm,相对原子质量为M,NA代表阿伏加德罗常数,请回答:
晶体中该原子的配位数为 ,一个晶胞中包含的原子数目为 ;该晶体的密度为 g·cm-3(用字母表示,不必化简)。
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的物质可判断,①是H,②是Be,③是C,④是N,⑤是O,⑥是F,⑦是Mg,⑧S,⑨是Cr,⑩是Cu。
(1)因为全充满或半充满是稳定的,所以根据构造原理可知Cr的外围电子排布式3d54s1。
(2)③与①形成的水果催熟剂是乙烯,乙烯中含有碳碳双键,采用的是sp2杂化。
非金属性越强,第一电离能越大,所以N<O。氮气中含有14个电子,所以和氮气互为等电子体的分子是CO,离子是C22-。N的氢化物是氨气,N的化合价处于最低价态,被双氧水氧化生成氮气。原电池中负极失去电子,所以氨气在负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O。
(4)S和C形成的非极性的直线形分子是CS2,所以反应的热化学方程式为CS2(l)+3O2(g)===CO2(g)+2SO2(g) ΔH=-1075 kJ/mol
(5)F是最活泼的非金属元素,H和F形成的氢化物中含有氢键,从而导致测得的值一般高于理论值。
(6)铜形成的是面心立方最密堆积,其配位数是12,根据乙中的结构特点可知一个晶胞中包含的原子数目为![]()
![]() 8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为
8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为 ,所以其密度为
,所以其密度为
查看习题详情和答案>>
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
⑧ |
|
|
|
|
|
|
|
|
⑨ |
|
|
|
|
⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④ 元素⑤(选填“>”、“=”、“<”)。
b.与元素④所形成的单质互为等电子体的分子、离子的化学式 、 (各写一种)。
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________________
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质。则其负极反应式为_____________________________。
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子。0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为_________________________
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。 已知该原子的半径为d pm,相对原子质量为M,NA代表阿伏加德罗常数,请回答:

晶体中该原子的配位数为 ,一个晶胞中包含的原子数目为 ;该晶体的密度为 g·cm-3(用字母表示,不必化简)。
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的物质可判断,①是H,②是Be,③是C,④是N,⑤是O,⑥是F,⑦是Mg,⑧S,⑨是Cr,⑩是Cu。
(1)因为全充满或半充满是稳定的,所以根据构造原理可知Cr的外围电子排布式3d54s1。
(2)③与①形成的水果催熟剂是乙烯,乙烯中含有碳碳双键,采用的是sp2杂化。
非金属性越强,第一电离能越大,所以N<O。氮气中含有14个电子,所以和氮气互为等电子体的分子是CO,离子是C22-。N的氢化物是氨气,N的化合价处于最低价态,被双氧水氧化生成氮气。原电池中负极失去电子,所以氨气在负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O。
(4)S和C形成的非极性的直线形分子是CS2,所以反应的热化学方程式为CS2(l)+3O2(g)===CO2(g)+2SO2(g) ΔH=-1075 kJ/mol
(5)F是最活泼的非金属元素,H和F形成的氢化物中含有氢键,从而导致测得的值一般高于理论值。
(6)铜形成的是面心立方最密堆积,其配位数是12,根据乙中的结构特点可知一个晶胞中包含的原子数目为
 8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为
8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为 ,所以其密度为
,所以其密度为
查看习题详情和答案>>
(1)已知相关物质之间存在如下变化:

丁与乙和水反应生成戊和丙的离子方程式为
(2)已知E 及其化合物有以下变化:

E的电子排布式为
| ||
| ||
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式:
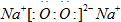
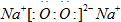
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式:
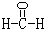
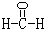
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
| 1 |
| 2 |
| 1 |
| 2 |
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式: