摘要:联想质疑:水在直流电的作用下分解 2H2O === 2H2 ↑ + O2↑ 思考:水在通电条件下发生分解反应.为什么要通电? 总结: 化学键的定义: 思考:应如何理解化学键的定义? 总结: 练习:下列图示中A.B对相邻的理解哪个是正确的? 分析:根据水在通电时分解成H2和O2 的过程中化学键的变化.你认为化学反应的实质是什么? 结论: 化学反应的实质是 练习:完成下列表格 化学反应 断裂的键 形成的键 2H2 +O2 ==2H2O H2+Cl2==2HCl N2+3H2==2NH3 引导分析:元素有一百多种.这些元素从大的角度分两类:金属元素.非金属元素.金属元素一般容易失电子.非金属元素一般容易得电子.我们发现非金属和非金属元素之间.非金属元素和金属元素之间.金属元素和金属元素之间大都可以通过化学键构成物质.它们之间的化学键是否一样呢? 回顾:(1)钠在氯气中的燃烧实验并写出反应的化学方程式 (2)氢气在氯气中的燃烧实验并写出反应的化学方程式 联想质疑:氢气在氯气中的燃烧形成氯化氢和钠在氯气中的燃烧形成氯化钠.在形成化学键方面是否相同? 交流研讨:请根据核外电子排布规律讨论:1. 氢原子和氯原子为什么有形成分子的趋势?
网址:http://m.1010jiajiao.com/timu3_id_193465[举报]
水在很多的反应中,起到极其重要的作用.根据下面水参与的反应,回答问题:
①2F2+2H2O═4HF+O2 ②2Na2O2+2H2O═4NaOH+O2↑
③2Na+2H2O═2NaOH+H2↑ ④2H2O
2H2↑+O2↑
(1)水只作氧化剂的是
(2)请标出下列反应的电子转移的方向和数目.
3Cl2+6NaOH=5NaCl+NaClO3+3H2O
(3)上述反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O若转移5mol电子,则所得氧化产物的物质的量为
查看习题详情和答案>>
①2F2+2H2O═4HF+O2 ②2Na2O2+2H2O═4NaOH+O2↑
③2Na+2H2O═2NaOH+H2↑ ④2H2O
| ||
(1)水只作氧化剂的是
③
③
;(填写序号,下同)水只作还原剂的是①
①
;水既作氧化剂,又做还原剂的是④
④
;水既不是氧化剂,又不是还原剂的氧化还原反应是②
②
.(2)请标出下列反应的电子转移的方向和数目.
3Cl2+6NaOH=5NaCl+NaClO3+3H2O
(3)上述反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O若转移5mol电子,则所得氧化产物的物质的量为
1
1
mol.水在很多的反应中,起到及其重要的作用.根据下面水参与的反应,回答问题:
①NaH+H2O═NaOH+H2↑ (NaH中H为-1价) ②2Na2O2+2H2O═4NaOH+O2↑
③2Na+2H2O═2NaOH+H2↑ ④CO2+H2O═H2CO3
⑤2H2O
2H2↑+O2↑ ⑥2F2+2H2O═4HF+O2
(1)水只作氧化剂的是
(2)水作氧化剂时,被还原的元素是
查看习题详情和答案>>
①NaH+H2O═NaOH+H2↑ (NaH中H为-1价) ②2Na2O2+2H2O═4NaOH+O2↑
③2Na+2H2O═2NaOH+H2↑ ④CO2+H2O═H2CO3
⑤2H2O
| ||
(1)水只作氧化剂的是
①③
①③
;(填写序号,下同)水只作还原剂的是⑥
⑥
;水既作氧化剂,又做还原剂的是⑤
⑤
;水既不是氧化剂,又不是还原剂的氧化还原反应是②
②
.(2)水作氧化剂时,被还原的元素是
H
H
(填元素符号),若电解1mol水,转移的电子数为2NA
2NA
个.
下列说法正确的是
①水在溶液中作氧化剂时1 mol水只能得到1 mol电子 ②保持温度不变,在Na2CO3的不饱和溶液中加Na2CO3粉末会使c(Na+)/c(![]() )比值减小 ③
)比值减小 ③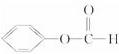 在碱溶液中水解1 mol该物质只消耗1 mol NaOH ④pH相同,体积相同的盐酸和醋酸分别与锌粉反应,则在单位时间内后者得到的氢气多
在碱溶液中水解1 mol该物质只消耗1 mol NaOH ④pH相同,体积相同的盐酸和醋酸分别与锌粉反应,则在单位时间内后者得到的氢气多
A.①② B.①④ C.①②③ D.②④
查看习题详情和答案>>
下列说法正确的是
①水在反应中作氧化剂时1 mol水只能得到1 mol电子
②保持温度不变,在Na2CO3的不饱和溶液中加Na2CO3粉末使c(Na+)/c(![]() )比值减小
)比值减小
③![]() 在NaOH溶液中水解,1 mol该物质只消耗1 mol NaOH
在NaOH溶液中水解,1 mol该物质只消耗1 mol NaOH
④pH相同,体积相同的盐酸和醋酸分别与锌粉反应,单位时间内后者得氢气多
A.①④ B.①②③
C.②④ D.①②
查看习题详情和答案>> 2H2↑+O2↑
2H2↑+O2↑