摘要: 在体积V L的密闭容器中.通入amolNO.bmolO2 反应后容器内氮原子和氧原子的个数比是( ) A.a/b B. a/2b C. a/ [当堂达标]
网址:http://m.1010jiajiao.com/timu3_id_193283[举报]
|
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在体积10 L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为 | |
| [ ] | |
A. |
v (NH3)=0.010 mol·L-1·s-1 |
B. |
v (O2)=0.0010 mol·L-1·s-1 |
C. |
v (NO)=0.0010 mol·L-1·s-1 |
D. |
v (H2O)=0.045 mol·L-1·s-1 |
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在体积10 L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为
- A.v(NH3)=0.010 mol·L-1·s-1
- B.v(O2)=0.0010 mol·L-1·s-1
- C.v(NO)=0.0010 mol·L-1·s-1
- D.v(H2O)=0.045 mol·L-1·s-1
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
(填”A”或”B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1<
<
m2.(选填”<“、”=“或”>“)(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).该反应的平衡常数表达式K=
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
减小
减小
(填”增大”“减小”或”不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=| 2nB |
| 3tB |
| 2nB |
| 3tB |
(3)难溶电解质在水溶液中存在着溶解平衡.在某温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Mg(OH)2(s)?Mg2+ (aq)+2OH- (aq),某温度下Ksp=c(Mg2+)[c(OH-)]2=2×10-11.若该温度下某MgSO4溶液里c(Mg2+)=0.002mol?L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于
10
10
;该温度下,在0.20L的0.002mol?L-1MgSO4溶液中加入等体积的0.10mol?L-1的氨水溶液,该温度下电离常数K(NH3?H2O)=2×10-5,经计算有
有
(填”有”或”无”)Mg(OH)2沉淀生成.(4)常温下,向某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈
碱
碱
性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的C| O | 2- 3 |
温室效应和资源短缺等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
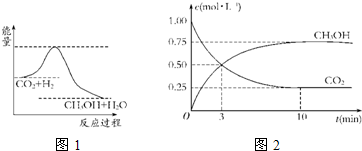
(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0
B.△H>0,△S<0
C.△H<0,△S<0
D.△H<0,△S>0
(2)该反应平衡常数K的表达式为
.
(3)温度降低,平衡常数K
(4)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
E.充入He(g),使体系总压强增大.
查看习题详情和答案>>

(1)关于该反应的下列说法中,正确的是
C
C
.A.△H>0,△S>0
B.△H>0,△S<0
C.△H<0,△S<0
D.△H<0,△S>0
(2)该反应平衡常数K的表达式为
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
(3)温度降低,平衡常数K
增大
增大
(填“增大”、“不变”或“减小”).(4)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)
0.225
0.225
mol?L-1?min-1.(5)下列措施中能使n(CH3OH)/n(CO2)增大的有
CD
CD
.A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
E.充入He(g),使体系总压强增大.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
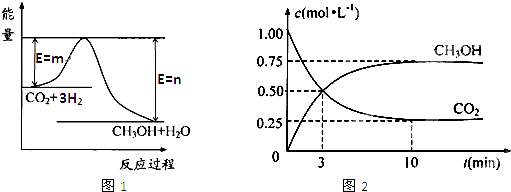
(1)写出该反应的热化学方程式
(2)关于该反应的下列说法中,正确的是
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为:
.
(4)温度降低,平衡常数K
(5)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=
(6)下列措施中能使n(CH3OH)/n(CO2)增大的有
A.升高温度 B.加入催化剂
C.将H2O(g)从体系中分离 D.充入He(g),使体系总压强增大.
查看习题详情和答案>>

(1)写出该反应的热化学方程式
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol?1
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol?1
.(2)关于该反应的下列说法中,正确的是
C
C
.A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为:
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
(4)温度降低,平衡常数K
增大
增大
(填“增大”、“不变”或“减小”).(5)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=
0.225mol/(L.min)
0.225mol/(L.min)
.(6)下列措施中能使n(CH3OH)/n(CO2)增大的有
C
C
.A.升高温度 B.加入催化剂
C.将H2O(g)从体系中分离 D.充入He(g),使体系总压强增大.