摘要:元素的相对原子质量的计算公式是: 例题2.设某种元素的原子核内质子数为m.中子数为n.则下列判断正确的是 A 不能由此确定该元素的相对原子质量. B 若碳原子的质量为W克.则此原 子的相对原子质量为:(m+n)W. C 该原子核的中子数总质量等于质子总质量. D 该元素的相对原子质量为m+n. 例3. 氯元素存在和两种同位素.其相对原子质量为35.5.求11.7g氯化钠晶体中含的质量为多少克?
网址:http://m.1010jiajiao.com/timu3_id_193190[举报]
1993年国际相对原子质量委员会确定,我国张青莲教授测定的锑元素的相对原子质量为121、760,为其标准相对原子质量。已知锑有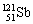 和
和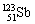 两种天然同位素,下列说法正确者( )
两种天然同位素,下列说法正确者( )
A.121、760是一个锑原子的质量与一个12C原子质量![]() 的比值
的比值
B.121、760是按锑的两种天然同位素的质量数与它们的原子百分比计算出来的平均值
C.天然存在的锑元素中![]() 和
和![]() 的原子个数比为31∶19
的原子个数比为31∶19
D.![]() 的原子质量与12C原子质量的比值是123∶1
的原子质量与12C原子质量的比值是123∶1
查看习题详情和答案>>
1993年国际相对原子质量委员会确定,我国张青莲教授测定的锑元素的相对原子质量为121、760,为其标准相对原子质量。已知锑有![]() 和
和![]() 两种天然同位素,下列说法正确者( )
两种天然同位素,下列说法正确者( )
A.121、760是一个锑原子的质量与一个12C原子质量![]() 的比值
的比值
B.121、760是按锑的两种天然同位素的质量数与它们的原子百分比计算出来的平均值
C.天然存在的锑元素中![]() 和
和![]() 的原子个数比为31∶19
的原子个数比为31∶19
D.![]() 的原子质量与12C原子质量的比值是123∶1
的原子质量与12C原子质量的比值是123∶1
查看习题详情和答案>>
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.(1)对反应N2O4(g)?2NO2(g),△H=+57kJ?mol-1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.
下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
(2)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②已知100℃反应2NO2?N2O4的平衡常数K=2.8.若该温度下某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正
③若在相同情况下最初向该容器只充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是
④计算在题③的条件下达到平衡后混合气体的平均相对分子质量为
(3)肼(N2H4)通常是航天航空的重要燃料,我们常用的一种肼燃料电池,是以肼与氧气的反应为原理设计的(N2H4+O2=N2+2H2O),其电解质溶液是KOH溶液.写出该电池负极的电极反应式
 两种天然同位素,下列说法正确的是
两种天然同位素,下列说法正确的是  的原子个数比为31:19
的原子个数比为31:19  的原子质量与12C原子质量的比值是123:1
的原子质量与12C原子质量的比值是123:1