网址:http://m.1010jiajiao.com/timu3_id_193099[举报]
随着世界杯足球赛的不断发展,人们对“足球”分子越来越感兴趣,读下列两则材料,回答相关问题:
材料一:科学家发现的C60是一种新的分子,它具有空心类似于足球的结构,分子中的每个碳原子只跟相邻的三个碳原子形成化学键,且分子中只含有五边形和六边形,被称为“分子足球”.1996年,某些国家的科研人员应用电子计算机将60个氮原子模拟成足球分子.结构表明:60个氮原子可以结合成与C60相似的足球状分子——N60,它与C60的结构相似,常温下能稳定存在,在高温或机械撞击时,其积蓄的巨大能量会一瞬间内释放出来,因而能用作单组分火箭的推进剂.
材料二:据某科学杂志报道,国外有一研究所发现了一种新的球形分子,它的分子式为C60Si60,它的分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构,硅原子与碳原子以共价键结合.
据上述材料下列说法正确的是________.
①N60与14N都是氮的同位素
②N60与C60互为同分异构体
③N60与N2互为同素异形体
④N60是共价化合物
⑤C60Si60是两种单质混合成类似于“合金”的混合物
⑥N60作火箭推进剂时发生了氧化还原反应
⑦N60分子中不含双键,C60Si60分子中也不含双键
⑧N60与C60Si60均是分子晶体
⑨N60具有较高硬度,而C60Si60硬度较小,熔点较低
⑩C60Si60分子中Si60被包裹在C60里面
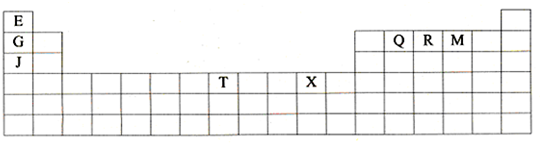
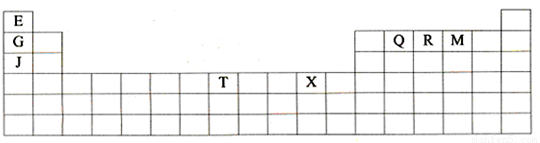
(1)T3+的核外电子排布式是:______
(2)Q、R、M的第一电离能由大到小的顺序是______(用元素符号表示)
(3)下列有关上述元素的说法中,正确的是:______(填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键.写出其结构式:______
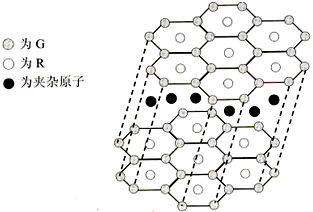
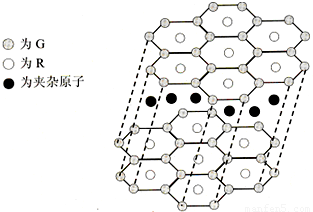
(5)G与R单质直接化合生成一种离子化合物G3R.该晶体具有类似石墨的层状结构.每层中,G原子构成平面六边形,每个六边形的中心有一个R原子.层与层之间还夹杂一定数量的原子.请问这些夹杂的原子应该是______(填G或R的元素符号)
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
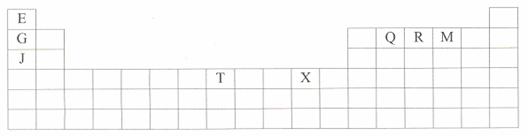
(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)
(3)下列有关上述元素的说法中,正确的是: (填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个![]() 键
键
(4)加拿大天文台在太空发出了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式:
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)
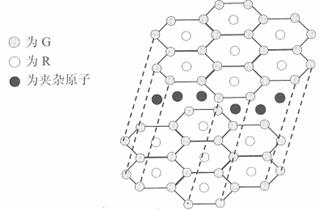
(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)
(3)下列有关上述元素的说法中,正确的是: (填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键.写出其结构式:
(5)G与R单质直接化合生成一种离子化合物G3R.该晶体具有类似石墨的层状结构.每层中,G原子构成平面六边形,每个六边形的中心有一个R原子.层与层之间还夹杂一定数量的原子.请问这些夹杂的原子应该是 (填G或R的元素符号)
 查看习题详情和答案>>
查看习题详情和答案>>
(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
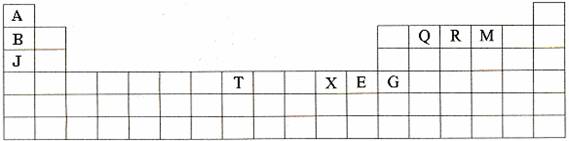
(1)T3+的核外电子排布式是: 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)下列有关上述元素的说法中,正确的是: (填序号)。
①B单质的熔点高于J单质,是因为B单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RA3沸点高于QA4,主要是因为前者相对分子质量较大
⑤一个Q2A4分子中含有五个σ键和一个![]() 键
键
(4)加拿大天文台在太空发现了AQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式: 。
(5)B与R单质直接化合生成一种离子化合物B3R。该晶体具有类似石墨的层状结构。每层中,B原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填B或R的元素符号)。
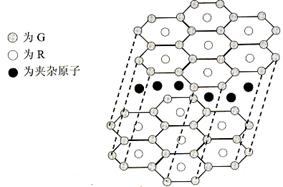
(6)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。但G的第一电离能却明显低于E,原因是 。
查看习题详情和答案>>