摘要:浓度对Fe3+ + 3SCN- 3反应平衡状态的影响:
网址:http://m.1010jiajiao.com/timu3_id_192989[举报]
废旧物的回收利用既有利于节约资源,又有利于保护环境.某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4?7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:
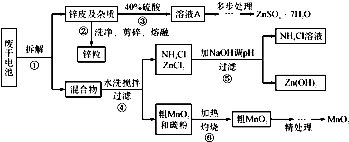
(1)操作②中所用的加热仪器应选
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:
(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
由上表数据分析应调节溶液pH最好为
a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol?L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
步骤3:向滤液中滴加0.5mol?L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为
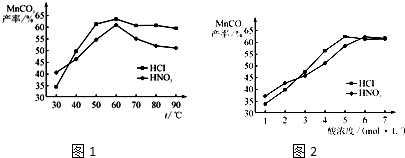
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol?L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择
查看习题详情和答案>>

(1)操作②中所用的加热仪器应选
坩埚
坩埚
(填“蒸发皿”或“坩埚”).(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
.(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
| NH3?H2O的Kb | Zn 2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
a
a
(填字母).a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol?L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
.步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
.步骤3:向滤液中滴加0.5mol?L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为
2MnCO3+O2
2MnO2+2CO2
| ||
2MnCO3+O2
2MnO2+2CO2
.
| ||
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol?L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
60
60
℃左右.②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择
6
6
mol?L-1左右.
 ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:
ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:(1)各元素的符号:
A:
Si
Si
,B:N
N
,C:S
S
,D:As
As
,X:P
P
.(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:
H2SO4>H3PO4>H3AsO4
H2SO4>H3PO4>H3AsO4
.(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:
NH3>PH3>SiH4
NH3>PH3>SiH4
.ⅡFe3+和I-在水溶液中的反应如下:2I-+2Fe3+?2Fe2++I2(水溶液),
(1)该反应的平衡常数K的表达式为:K=
| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
[物质的浓度用“c(物质)”表示].当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡
向右
向右
移动(填“向右”、“向左”、“不”).(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
| c(I-)(mol/L) | c(Fe3+)(mol/L) | v[mol/(L?s)] | |
| (1) | 0.20 | 0.80 | 0.032K |
| (2) | 0.60 | 0.40 | 0.144K |
| (3) | 0.80 | 0.20 | 0.128K |
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为
C
C
.A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
②I-浓度对反应速率的影响
>
>
Fe3+浓度对反应速率的影响(填“>”、“<”或“=”).(2011?江苏一模)高铁酸钾是一种高效的多功能的水处理剂.工业上常采用NaClO氧化法生产,原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,Na2FeO4+2KOH=K2FeO4+2NaOH,主要的生产流程如下:

(1)写出反应①的离子方程式
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4)
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.
①工业生产中最佳温度为
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
③若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:
(4)K2FeO4 在水溶液中易水解:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇.
查看习题详情和答案>>

(1)写出反应①的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4)
<
<
Ksp(Na2FeO4)(填“>”或“<”或“=”).(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.

图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.
①工业生产中最佳温度为
26
26
℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为1.2
1.2
.②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO
3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO
.③若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:
2FeO42-+Fe3++8OH-=3FeO43-+4H2O
2FeO42-+Fe3++8OH-=3FeO43-+4H2O
.(4)K2FeO4 在水溶液中易水解:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
B
B
溶液(填序号).A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇.
试述实验室证明浓度对化学平衡影响实验过程.
反应原理(用离子方程式表示):
操作步骤及现象:
查看习题详情和答案>>
反应原理(用离子方程式表示):
Fe3++SCN-?Fe(SCN)3
Fe3++SCN-?Fe(SCN)3
操作步骤及现象:
| 实验步骤 | 实验现象 | 解释和结论 |
| (1)在小烧杯中加入0.1mol/LFeCl3溶液2mL和0.1mol/LNH4SCN溶液2mL.加水10ml,混匀后分装于3支试管中. | 反应后形成红色溶液. | |
| (2) 往第一支试管加入少量三氯化铁溶液 往第一支试管加入少量三氯化铁溶液 |
试管中溶液 颜色加深 试管中溶液 颜色加深 |
增大反应物浓度促使 化学平衡向正反应的 方向移动 增大反应物浓度促使 化学平衡向正反应的 方向移动 |
| (3) 往第二支试管中加入少量硫氰化钾溶液 往第二支试管中加入少量硫氰化钾溶液 |
试管中溶液 颜色加深 试管中溶液 颜色加深 |
增大反应物浓度促使 化学平衡向正反应的 方向移动 增大反应物浓度促使 化学平衡向正反应的 方向移动 |
| (4)比较上述三支试管的颜色. | 加入铁离子或硫氰根离子都能使溶液 颜色加深 加入铁离子或硫氰根离子都能使溶液 颜色加深 |
增大任何一种反应物 的浓度促使化学平衡向正反应的方向移动 增大任何一种反应物 的浓度促使化学平衡向正反应的方向移动 |
保护环境是全球关注的问题.
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):

某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究.
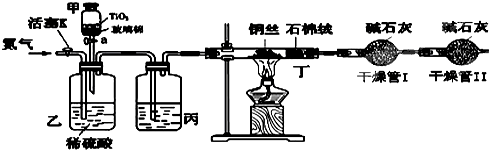
操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol?L-1)加到装置甲中,塞上橡皮塞.
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关.
iii.测定干燥管I增加的质量.
(1)写出装置乙中反应的离子方程式: .
(2)装置丙中的试剂是 ,装置丁的作用是 .
(3)假定上述实验中的气体都被充分吸收.若干燥管I增重1.408g.则CN-被处理的百分率为 .
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将 (填“偏高”、“偏低”、“无法确定”或“无影响”).简述你的理由: .
Ⅱ.防治空气污染,燃煤脱硫很重要.目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果.
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2.
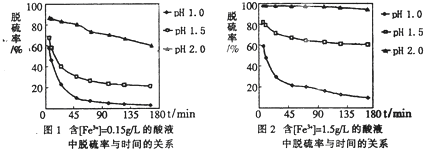
为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是 、 .
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去.
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀.
上述实验方案中不合理的是 .
查看习题详情和答案>>
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):

某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究.

操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol?L-1)加到装置甲中,塞上橡皮塞.
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关.
iii.测定干燥管I增加的质量.
(1)写出装置乙中反应的离子方程式:
(2)装置丙中的试剂是
(3)假定上述实验中的气体都被充分吸收.若干燥管I增重1.408g.则CN-被处理的百分率为
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将
Ⅱ.防治空气污染,燃煤脱硫很重要.目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果.
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2.

为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去.
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀.
上述实验方案中不合理的是